
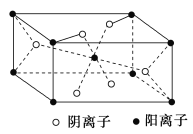
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЮЊЧАЫФжмЦкдЊЫиЃЌЧвдзгађЪ§вРДЮдіДѓЁЃЦјЬхABгіПеЦјБфКьзиЩЋЃЌCдзгФкВуЕчзгЪ§ЪЧзюЭтВуЕчзгЪ§ЕФ5БЖЃЌDдкЭЌжмЦкдЊЫижаЕчИКадзюДѓЃЌEЕФСђЫсбЮШмвКГЪРЖЩЋЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉAдзгга________жжФмСПВЛЭЌЕФЕчзгЃЛDдзгЕФMФмВуЕчзгЕФдЫЖЏзДЬЌга________жжЁЃ
ЃЈ2ЃЉдЊЫиAЕФЕквЛЕчРыФм________ЃЈЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБЃЉдЊЫиBЕФЕквЛЕчРыФмЃЛAB2-ЕФСЂЬхЙЙаЭЪЧ________ЃЛЦјЬхABжаКЌгаЕФІвМќКЭІаМќИіЪ§жЎБШЮЊ________ЁЃ
ЃЈ3ЃЉдЊЫиCгыDЫљаЮГЩЕФЛЏКЯЮяЕФФГжжОЇАћНсЙЙШчЭМЫљЪОЃЌдђОЇАћжавѕРызггыбєРызгЕФИіЪ§БШЪЧ________ЃЎ
ЃЈ4ЃЉEЛљЬЌдзгЕФКЫЭтЕчзгХХВМЪНЮЊ________ЃЌНЋEЕЅжЪЕФЗлФЉМгШыAЕФМђЕЅЦјЬЌЧтЛЏЮяЕФХЈШмвКжаЃЌВЂВЛЖЯЙФШыПеЦјГфЗжЗДгІЃЌЕУЕНЩюРЖЩЋЕФШмвКЃЌИУЗДгІЕФРызгЗНГЬЪНЪЧ________ЁЃ
ЁОД№АИЁП3 7 Дѓгк VаЮ 1ЁУ2 2ЁУ1 1s22s22p63s23p63d104s1Лђ[Ar]3d104s1 2Cu+8NH3ЁЄH2O+O2=2[Cu(NH3)4]2ЃЋ+4OH-+6H2O
ЁОНтЮіЁП
AЁЂBЁЂCЁЂDЁЂEЮЊЧАЫФжмЦкдЊЫиЃЌЧвдзгађЪ§вРДЮдіДѓЃЌгЩЦјЬхABгіПеЦјБфКьзиЩЋПЩжЊЃЌAЮЊNдЊЫиЁЂBЮЊOдЊЫиЃЛCдзгФкВуЕчзгЪ§ЪЧзюЭтВуЕчзгЪ§ЕФ5БЖЃЌдђCЪЧMgдЊЫиЃЛEЕФСђЫсбЮШмвКГЪРЖЩЋЃЌдђEЮЊCuдЊЫиЃЛDЕФдзгађЪ§аЁгкEЃЌЧвдкЭЌжмЦкдЊЫижаЕчИКадзюДѓЃЌдђDЮЊClдЊЫиЁЃ
ЃЈ1ЃЉAЮЊNдЊЫиЃЌдзгЕФЕчзгХХВМЪНЮЊ1s22s22p4ЃЌдђдзгКЫЭтга1sЁЂ2sКЭ2pШ§жжФмСПВЛЭЌЕФЕчзгЃЛDЮЊClдЊЫиЃЌMФмВуЩЯгаЦпИіЕчзгЃЌдђЕчзгЕФдЫЖЏзДЬЌгаЦпжжЃЌЙЪД№АИЮЊ3ЃЛ7ЃЛ
ЃЈ2ЃЉNдзг2pЙьЕРЮЊАыГфТњЕФЮШЖЈзДЬЌЃЌдђдЊЫиNЕФЕквЛЕчРыФмДѓгкдЊЫиOЕФЕквЛЕчРыФмЃЛNO2-жаЕЊдзгЕФЙТЕчзгЖдЪ§ЮЊ![]() ЃЌМлВуЕчзгЖдЪ§ЮЊ
ЃЌМлВуЕчзгЖдЪ§ЮЊ![]() ЃЌЙЪNO2-ЕФСЂЬхЙЙаЭЪЧVаЮЃЛNOЮЊжБЯпаЭМЋадЗжзгЃЌЗжзгжаNдзгВЩШЁspдгЛЏЃЌга1ИіІвМќЁЂ1ИіІаМќКЭвЛИіДѓІаМќЃЌдђІвМќКЭІаМќИіЪ§жЎБШЮЊ1:2ЃЌЙЪД№АИЮЊаЁгкЃЛVаЮ ЃЛ1ЃК2ЃЛ
ЃЌЙЪNO2-ЕФСЂЬхЙЙаЭЪЧVаЮЃЛNOЮЊжБЯпаЭМЋадЗжзгЃЌЗжзгжаNдзгВЩШЁspдгЛЏЃЌга1ИіІвМќЁЂ1ИіІаМќКЭвЛИіДѓІаМќЃЌдђІвМќКЭІаМќИіЪ§жЎБШЮЊ1:2ЃЌЙЪД№АИЮЊаЁгкЃЛVаЮ ЃЛ1ЃК2ЃЛ
ЃЈ3ЃЉОЇАћжабєРызгДІгкЬхаФгыЖЅЕуЃЌОЇАћжабєРызгЪ§ФПЮЊ![]() ЃЌвѕРызгДІгкЬхФкМАУцЩЯЃЌОЇАћжавѕРызгЪ§ФПЮЊ
ЃЌвѕРызгДІгкЬхФкМАУцЩЯЃЌОЇАћжавѕРызгЪ§ФПЮЊ![]() ЃЌЙЪОЇАћжавѕРызггыбєРызгЕФИіЪ§БШЪЧ4ЃК2=2ЃК1ЃЌЙЪД№АИЮЊ2:1ЃЛ
ЃЌЙЪОЇАћжавѕРызггыбєРызгЕФИіЪ§БШЪЧ4ЃК2=2ЃК1ЃЌЙЪД№АИЮЊ2:1ЃЛ
ЃЈ4ЃЉНЋCuЕЅжЪЕФЗлФЉМгШыNH3ЕФХЈШмвКжаЃЌЭЈШыO2ЃЌЭБЛбѕЦјбѕЛЏЩњГЩЫФАБКЯЭХфРызгЃЌЗДгІЕФРызгЗНГЬЪНЮЊ2Cu+8NH3ЁЄH2O+O2=2[Cu(NH3)4]2ЃЋ+4OH-+6H2OЃЌЙЪД№АИЮЊ2Cu+8NH3ЁЄH2O+O2=2[Cu(NH3)4]2ЃЋ+4OH-+6H2OЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌ НЋЯЁ HClШмвКЕЮМгЕНЕШХЈЖШЕФШѕМю AOHШмвКжаЃЌ ВтЕУЛьКЯвКЕФ pHКЭlg[C(AOH)/C(A+)] ЕФЙиЯЕШчЭМЫљЪОЃЌ Цфжа aЕуБэЪОЮДМгбЮЫсЪБЕФЪ§ОнЃЌ eЕуБэЪО HClКЭ AOHЧЁКУЭъШЋЗДгІЪБЕФЪ§ОнЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. ГЃЮТЯТЃЌ A+ЕФЫЎНтЦНКтГЃЪ§ЮЊ 1.0ЁС10Ѓ10
B. ЕуeШмвКжаЫЎЕчРыГіЕФH+ХЈЖШЮЊ 10Ѓ6.23mol/L
C. Еуc ШмвКжаЕФ n(A+)+n(AOH)ЕШгкЕу eШмвКжаЕФ n(ClЃ)
D. ЕуdШмвКжаЃК c(ClЃ)> c(AOH)>c(A+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВнЫс(H2C2O4)ЪЧвЛжжЖўдЊШѕЫсЁЃГЃЮТЯТЯђH2C2O4ШмвКжаЕЮМгNaOHШмвКЃЌЛьКЯШмвКРяlgX[XБэЪО![]() Лђ
Лђ![]() ]ЫцpHЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
]ЫцpHЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. жБЯпIжаXБэЪОЕФЪЧ![]()
B. жБЯпIЁЂЂђЕФаБТЪОљЮЊ1
C. c(HC2O4Ѓ)>c(C2O42Ѓ)>c(H2C2O4)ЖдгІ1.22<pH<4.19
D. c(Na+)=c(HC2O4Ѓ)+2c(C2O42Ѓ)ЖдгІpH=7
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАБПЩгУгкжЦШЁАБЫЎЁЂЕЊЗЪЁЂЯѕЫсЁЂяЇбЮЁЂДПМюЕШЃЌвђДЫБЛЙуЗКгІгУгкЛЏЙЄЁЂЧсЙЄЁЂЛЏЗЪЁЂжЦвЉЁЂКЯГЩЯЫЮЌЁЂЫмСЯЕШаавЕЃЎ
ЃЈ1ЃЉвдМзЭщЮЊдСЯПЩжЦЕУКЯГЩАБгУЕФЧтЦјЃЌгаЙиЗДгІЕФФмСПБфЛЏШчЯТЭМЫљЪОЃК
 ЁЁ
ЁЁ

аДГіCH4(g)гыH2O(g)ЗДгІЩњГЩCO(g)КЭH2(g)ЕФШШЛЏбЇЗНГЬЪНЃК_______________ЁЃ
ЃЈ2ЃЉвбжЊN2(g)ЃЋ3H2(g)![]() 2NH3(g)ЃЛЁїH= -94.4kJЁЄmol-1ЃЌдкФГШнЛ§ЮЊ2LЕФКуШнШнЦїжаЗЂЩњКЯГЩАБЗДгІЃЌЬхЯЕжаИїЮяжЪХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЭМЫљЪОЃК
2NH3(g)ЃЛЁїH= -94.4kJЁЄmol-1ЃЌдкФГШнЛ§ЮЊ2LЕФКуШнШнЦїжаЗЂЩњКЯГЩАБЗДгІЃЌЬхЯЕжаИїЮяжЪХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЭМЫљЪОЃК

ЂйЧА20minФкv(NH3)=________mol/(LЁЄmin)ЃЌЗХГіЕФШШСПЮЊ________ЁЃ
Ђк45minЪБВЩШЁЕФДыЪЉЪЧ________ЃЛЪБЖЮIIIЬѕМўЯТЗДгІЕФЦНКтГЃЪ§ЮЊ________ЃЈБЃСє3ЮЛгааЇЪ§зжЃЉЁЃ
ЃЈ3ЃЉвЛЖЈЮТЖШЯТЃЌНЋВЛЭЌСПЕФCO2ЁЂNH3ЗжБ№ЭЈШыФГКуШнУмБеШнЦїжаНјааЯТСаЗДгІЃК2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(g)ЃЛЁїHЃМ0ЃЌЕУЕНШчЯТЪ§ОнЃК
ЪЕбщзщ | Ц№ЪМСП/mol | ЦНКтЪБЕФзЊЛЏТЪ | ЦНКтЪБЦјЬхЦНОљЯрЖдЗжзгжЪСП | ||
NH3(g) | CO2(g) | NH3(g) | CO2(g) | ||
1 | 2 | 1 | a1 | a2 | M1 |
2 | 4 | 2 | a3 | a4 | M2 |
3 | n1 | n2 | a5 | a6 | M3 |
Ђйa1________a4ЃЈЬюЁАЃМЁБЁЂЁАЃНЁБЛђЁАЃОЁБЃЉЃЛM1________ M2ЃЈЬюЁАЃМЁБЁЂЁАЃНЁБЛђЁАЃОЁБЃЉЁЃ
ЂкШєa5>a6ЃЌдђn1ЃЌn2БиаыТњзуЕФЙиЯЕЪЧ________ЁЃ
ЃЈ4ЃЉЪвЮТЪБНЋАБЭЈШы500mL 0.1molЁЄL-1бЮЫсжажСpH=6ЃЌЫљЕУШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ____________________________________________ЁЃ
ЃЈ5ЃЉАБЁЂПеЦјЁЂKOHШмвКПЩЙЙГЩШМСЯЕчГиЃЌЗДгІдРэЮЊ4NH3+3O2=2N2+6H2OЃЌЗДгІвЛЖЮЪБМфКѓЃЌЕчНтжЪШмвКЕФpHНЋ________ЃЈЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчИЁбЁФ§ОлЗЈЪЧЙЄвЕЩЯВЩгУЕФвЛжжЮлЫЎДІРэЗНЗЈЃЌМДБЃГжЮлЫЎЕФpHдк5.0~6.0жЎМфЃЌЭЈЙ§ЕчНтЩњГЩFe(OH)3НКЬхЃЌFe(OH)3НКЬхОпгаЮќИНзїгУЃЌПЩЮќИНЫЎжаЕФЮлЮяЖјЪЙЦфГСЕэЯТРДЃЌЦ№ЕНОЛЫЎЕФзїгУЃЌЦфдРэШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. ЪЏФЋЕчМЋЩЯЗЂЩњбѕЛЏЗДгІ B. ЭЈМзЭщЕФЕчМЋЗДгІЪНЃКCH4+4CO32--8e-=5CO2+2H2O
C. ЭЈПеЦјЕФЕчМЋЗДгІЪНЮЊO2+4e-=2O2- D. МзЭщШМСЯЕчГижаCO32-ЯђПеЦјвЛМЋвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЫљЪОгыЖдгІа№ЪіЯрЗћЕФЪЧ
A.ЭМ БэЪОвЛЖЈЮТЖШЯТFeSКЭCuSЕФГСЕэШмНтЦНКтЧњЯпЃЌдђ Ksp(FeS)<Ksp(CuS)
БэЪОвЛЖЈЮТЖШЯТFeSКЭCuSЕФГСЕэШмНтЦНКтЧњЯпЃЌдђ Ksp(FeS)<Ksp(CuS)
B.ЭМ БэЪОЕШЬхЛ§ЕФpH=2ЕФМзЫсгыввЫсШмвКЯЁЪЭЪБЕФpHБфЛЏЧњЯпЃЌдђЫсадЃКМзЫс<ввЫс
БэЪОЕШЬхЛ§ЕФpH=2ЕФМзЫсгыввЫсШмвКЯЁЪЭЪБЕФpHБфЛЏЧњЯпЃЌдђЫсадЃКМзЫс<ввЫс
C.ФГЮТЖШЯТЯђ20 mL 0.1 molЁЄL-1ЕФCH3COOHШмвКжаж№ЕЮМгШы0.1 molЁЄL-1NaOHШмвКЃЌpHБфЛЏЧњЯпШчЭМЫљЪО (КіТдЮТЖШБфЛЏ)ЃЌдђЂйЕу(CH3COOЁЊ)>c(Na+)>c(CH3COOH)
(КіТдЮТЖШБфЛЏ)ЃЌдђЂйЕу(CH3COOЁЊ)>c(Na+)>c(CH3COOH)
D.ЭМ БэЪОЗДгІN2(g)+3H2(g)
БэЪОЗДгІN2(g)+3H2(g)![]() 2NH3(g)ЦНКтЪБNH3ЬхЛ§ЗжЪ§ЫцЦ№ЪМ nЃЈN2ЃЉ/nЃЈH2ЃЉБфЛЏЕФЧњЯпЃЌдђзЊЛЏТЪЃКІСA(H2)=ІСB(H2)
2NH3(g)ЦНКтЪБNH3ЬхЛ§ЗжЪ§ЫцЦ№ЪМ nЃЈN2ЃЉ/nЃЈH2ЃЉБфЛЏЕФЧњЯпЃЌдђзЊЛЏТЪЃКІСA(H2)=ІСB(H2)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк1200ЁцЪБЃЌЬьШЛЦјЭбСђЙЄвежаЛсЗЂЩњЯТСаЗДгІ
ЂйH2S(g)+![]() O2(g)=SO2(g)+H2O(g) ЁїH1
O2(g)=SO2(g)+H2O(g) ЁїH1
Ђк2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ЁїH2
S2(g)+2H2O(g) ЁїH2
ЂлH2S(g)+![]() O2(g)=S(g)+H2O(g) ЁїH3
O2(g)=S(g)+H2O(g) ЁїH3
Ђм2S(g) =S2(g) ЁїH4
дђЁїH4ЕФе§ШЗБэДяЪНЮЊЃЈ ЃЉ
A. ЁїH4=2/3ЃЈЁїH1+ЁїH2-3ЁїH3ЃЉ
B. ЁїH4=2/3ЃЈ3ЁїH3-ЁїH1-ЁїH2ЃЉ
C. ЁїH4=3/2ЃЈЁїH1+ЁїH2-3ЁїH3ЃЉ
D. ЁїH4=3/2ЃЈЁїH1-ЁїH2-3ЁїH3ЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФПЧАЙЄвЕЩЯПЩРћгУCOЛђCO2РДЩњВњШМСЯМзДМЃЌФГбаОПаЁзщЖдЯТСагаЙиМзДМжЦШЁЕФШ§ЬѕЛЏбЇЗДгІдРэНјааЬНОПЁЃвбжЊдкВЛЭЌЮТЖШЯТЕФЛЏбЇЗДгІЦНКтГЃЪ§(K1ЁЂK2ЁЂK3)ШчЯТБэЫљЪОЃК
ЛЏбЇЗДгІ | ьЪБф | ЦНКтГЃЪ§ | ЮТЖШ/Ёц | ||
500 | 700 | 800 | |||
Ђй2H2(g)ЃЋCO(g) | ІЄH1 | K1 | 2.5 | 0.34 | 0.15 |
ЂкCO2(g)ЃЋH2(g) | ІЄH2 | K2 | 1.0 | 1.70 | 2.52 |
ЂлCO2(g)ЃЋ3H2(g) | ІЄH3 | K3 | |||
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)ЗДгІЂкЪЧ________(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІЁЃ
(2)ИљОнЗДгІЂйгыЂкПЩЭЦЕМГіK1ЁЂK2гыK3жЎМфЕФЙиЯЕЃЌдђK3ЃН________(гУK1ЁЂK2БэЪО)ЃЛИљОнЗДгІЂлХаЖЯІЄS___0(ЬюЁА>ЁБЁЂЁАЃНЁБЛђЁА<ЁБ)ЃЌдк______(ЬюЁАНЯИпЁБЛђЁАНЯЕЭЁБ)ЮТЖШЯТгаРћгкИУЗДгІздЗЂНјааЁЃ
(3)500ЁцЪБЃЌВтЕУЗДгІЂлдкФГЪБПЬЃЌCO2(g)ЁЂH2(g)ЁЂCH3OH(g)ЁЂH2O(g)ЕФХЈЖШЗжБ№ЮЊ0.1mol/LЁЂ0.8mol/LЁЂ0.3mo/LЁЂ0.15mol/LЃЌдђДЫЪБvе§________vФц(ЬюЁА>ЁБЁЂЁАЃНЁБЛђЁА<ЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌгУ0.100molЁЄL-1ЕФNaOHШмвКЗжБ№ЕЮЖЈОљЮЊ20.00mL0.100molЁЄL-1ЕФHClШмвККЭДзЫсШмвКЃЌЕЮЖЈЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. IБэЪОЕФЪЧЕЮЖЈДзЫсЕФЧњЯп
B. pH =7ЪБЃЌЕЮЖЈДзЫсЯћКФЕФV(NaOH)ЃО20.00mL
C. V(NaOH)= 20.00mLЪБЃЌСНЗнШмвКжаc(Cl-)ЃОc(CH3COO-)
D. V(NaOH)=10.00mLЪБЃЌДзЫсжаc(Na+)ЃОc(CH3COO-)ЃОc(H+)ЃОc(OH-)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com