
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
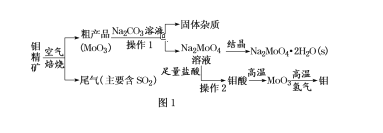
已知:钼酸微溶于水,可溶于液碱和氨水。回答下列问题:
(1)钼精矿焙烧时,每有1molMoS2反应,转移电子的物质的量为______。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是________,请你设计工业上除去该尾气的方法(写出两种“变废为宝”的方法和离子方程式):___________;___________。
(3)由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是_______。
(4)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol/L,c(SO42-)=0.04mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是_____。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
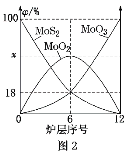
(5)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
①x=_____。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的物质的量为____。
【答案】14mol 形成酸雨 可用氨水吸收后制成氮肥,并为硫酸工业提供原料气 2NH3·H2O+SO2=2NH4++SO32-+H2O,SO32-+2H+=SO2↑+H2O 瓷坩埚 94.5% 64 3mol
【解析】
(1)钼精矿焙烧时,MoS2被氧气氧化为MoO3和SO2;
(2)钼精矿焙烧时排放的尾气SO2是酸性氧化物;工业上可以用氨水吸收制取氮肥,并为硫酸工业提供原料气;
(3)钼酸灼烧得到MoO3;
(4)根据Ksp(BaMoO4)=4.0×108计算BaMoO4开始沉淀时c(Ba2+),再根据c(Ba2+)和 Ksp(BaSO4)=1.1×1010计算溶液中c(SO42-);
(5)①第6层炉含有MoO2、MoS2、MoO3,根据Mo元素守恒计算x;
②MoS2与MoO3反应生成MoO2和SO2的方程式是MoS2+6MoO3![]() 7MoO2+2SO2;
7MoO2+2SO2;
(1)钼精矿焙烧时,MoS2被氧气氧化为MoO3和SO2,反应方程式为2MoS2+7O2![]() 2MoO3+4SO2,所以每有1molMoS2反应,转移电子的物质的量为14mol;
2MoO3+4SO2,所以每有1molMoS2反应,转移电子的物质的量为14mol;
(2)钼精矿焙烧时排放的尾气SO2是酸性氧化物,对环境的主要危害是形成酸雨;工业上可用氨水吸收后制成氮肥,并为硫酸工业提供原料气,反应方程式是2NH3·H2O+SO2=2NH4++SO32-+H2O,SO32-+2H+=SO2↑+H2O;
(3)钼酸灼烧得到MoO3,灼烧固体的仪器是瓷坩埚;
(4)c(MoO42-)=0.80mol/L,则BaMoO4开始沉淀时c(Ba2+)= 5×10-8,此时c(SO42-)=
5×10-8,此时c(SO42-)=![]() 2.2 ×10-3,SO42-的去除率是
2.2 ×10-3,SO42-的去除率是![]() ;
;
(5)第6层炉含有MoO2、MoS2、MoO3,MoS2、MoO3的含量分别为18%,根据Mo元素守恒,MoO2的含量为1-18%-18%=64%;
②MoS2与MoO3反应生成MoO2和SO2的方程式是MoS2+6MoO3![]() 7MoO2+2SO2,MoO3中Mo元素由+6价降低为+4,MoO3是氧化剂,若转移6mol电子,则消耗MoO3的物质的量为3mol。
7MoO2+2SO2,MoO3中Mo元素由+6价降低为+4,MoO3是氧化剂,若转移6mol电子,则消耗MoO3的物质的量为3mol。


科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,常温下A的单质是深红棕色的液体,B、C、D是短周期元素。D元素原子K层的电子数是B元素原子核外电子总数的2倍。C、D元素原子最外层电子数相同,D元素原子核内质子数是C元素原子核内质子数的2倍。
(1)由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式:①__________________;②____________________。
(2)写出各元素原子的电子排布式:A_____________,B______________,C____________,D____________。
(3)比较C、D两元素的性质:①第一电离能:C________D(填“<”或“>”,下同);②电负性:C________D;③非金属性:C________D;④原子半径:C________D。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.Fe+CuSO4=FeSO4+CuB.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO![]() 2Fe+3CO2D.MgCl2(熔融)
2Fe+3CO2D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和硼的化合物在工业上有着广泛的用途。
(1)基态硼原子的电子排布式为___________________________。
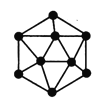
(2)晶体硼的基本结构单元是由硼原子构成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个硼原子。此结构单元中含有硼原子的数目为________________。
(3)氮化硼(BN)晶体有多种结构。六方氮化硼与石墨相似,具有层状结构,可作高温润滑剂。立方氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法中,正确的是____(填标号)。

a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 B—N 键均为共价键
d.两种晶体均为分子晶体
(4)六方氮化硼晶体内硼原子的杂化方式为________,该晶体不导电的原因是___________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。与BF4—互为等电子体的一种分子的化学式为__, lmolNH4BF4晶体中含有配位键的数目为_____________。
(6)立方氮化硼的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,则立方氮化硼的一个晶胞中含有______个硼原子,立方氮化硼的密度是____gcm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。下列说法不正确的是( )

A. 原料X与中间体Y互为同分异构体
B. 原料X可以使酸性KMnO4溶液褪色
C. 中间体Y能发生还原、加成、取代、氧化、水解反应
D. 1 mol依曲替酯只能与1 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18.4 mol·L-1的浓H2SO4来配制500 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒、②烧瓶、③烧杯、④胶头滴管、⑤量筒、⑥容量瓶、⑦托盘天平。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)________。
(2)经计算,需量取浓H2SO4 ________mL。现有①10 mL、②50 mL、③100 mL三种规格的量筒,你选用的量筒是________(写序号)。
(3)将浓H2SO4加入到适量蒸馏水中稀释后,冷却片刻,随后全部转移到______ mL的容量瓶中。
(4)在配制过程中,其他操作都准确,下列操作中能引起误差偏高的有________(填代号)。
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
②转移前,容量瓶中含有少量蒸馏水
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线
(5)在下图的配制过程示意图中,正确的是(填写序号)_______。
A.称量
B.溶解
C.转移
D.定容![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鹅去氧胆酸和胆烷酸都可以降低肝脏中的胆固醇,二者的转化关系如图,下列说法中正确的是
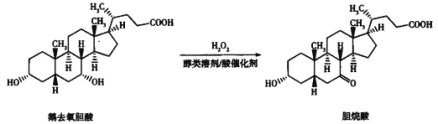
A. 二者互为同分异构体
B. 二者均能发生氧化反应和取代反应
C. 胆烷酸中所有碳原子可能处于同一平面内
D. 等物质的量的鹅去氧胆酸和胆烷酸与足量Na反应时,最多消耗Na的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡妥油(D)用作香料的原料,它可由A合成得到:
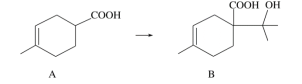
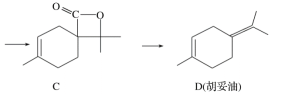
下列说法正确的是
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 有机物C的所有同分异构体中可能有芳香族化合物存在
D. 1 mol有机物A中含有6.02×1023个双键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com