
【题目】有A、B、C、D四种元素,常温下A的单质是深红棕色的液体,B、C、D是短周期元素。D元素原子K层的电子数是B元素原子核外电子总数的2倍。C、D元素原子最外层电子数相同,D元素原子核内质子数是C元素原子核内质子数的2倍。
(1)由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式:①__________________;②____________________。
(2)写出各元素原子的电子排布式:A_____________,B______________,C____________,D____________。
(3)比较C、D两元素的性质:①第一电离能:C________D(填“<”或“>”,下同);②电负性:C________D;③非金属性:C________D;④原子半径:C________D。
【答案】Br2+H2S===2HBr+S↓ 2H2S+O2===2H2O+2S↓ 1s22s22p63s23p63d104s24p5 1s1 1s22s22p4 1s22s22p63s23p4 > > > <
【解析】
A、B、C、D四种元素,A元素的单质是深红棕色的液体,则A单质是溴,则A元素是Br元素;B、C、D是短周期元素,即均不超过3个电子层,D元素原子K层的电子数是B元素原子核外电子总数的2倍,所以B为H, C、D元素原子最外层电子数相同,说明是同一主族元素,C元素原子核内质子数是D元素原子核内质子数的![]() ,所以C为O,D为S,据此分析。
,所以C为O,D为S,据此分析。
A、B、C、D四种元素,A元素的单质是深红棕色的液体,则A单质是溴,则A元素是Br元素;B、C、D是短周期元素,即均不超过3个电子层,D元素原子K层的电子数是B元素原子核外电子总数的2倍,所以B为H, C、D元素原子最外层电子数相同,说明是同一主族元素,C元素原子核内质子数是D元素原子核内质子数的![]() ,所以C为O,D为S,则:
,所以C为O,D为S,则:
(1) 由上述元素组成的一种单质和化合物相互作用生成沉淀的两个反应的化学方程式为:
①Br2+ H2S=2HBr+S↓;②2H2S+O2=2S↓+2H2O;
(2)电子排布式为:A:1s22s22p63s23p63d104s24p5;
B:1s1;
C:1s22s22p4;
D:1s22s22p63s23p4;
(3)①同一主族从上到下,第一电离能逐渐减小,所以第一电离能:C>D;
②同一主族从上到下,电负性逐渐减小,所以电负性: C>D;
③同主族元素从上到下非金属性逐渐减弱,所以非金属性:C>D;
④同一主族从上到下,原子半径逐渐增大,所以原子半径: C<D。


科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2υ正(A)=υ逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=______________。在保证A浓度不变的情况下,扩大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。
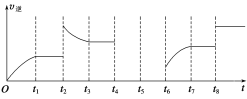
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时__________________;t8时_________________________。
②t2时平衡向________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)X是含有________键(填“非极性”或“极性”,下同)的________分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________。
(4)Y分子的空间构型为__________,其中心原子采取________杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________。
(6)Y是一种易液化的气体,请简述其易液化的原因_________。
(7)写出E2+的电子排布式___________________,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃的条件下,将体积比为1:1总质量为7.2g的CO与H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为( )
A.4.5 gB.7.2 gC.9.3 gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
![]()
(1)若A是一种活泼金属,C是淡黄色固体,则C的名称为________________,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理______________________。
(2)若A是一种黄色单质固体,则B→C的化学方程式为________________。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为________________(填写化学式,下同),C为___________________;实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:_____________________________。
②写出C与水反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
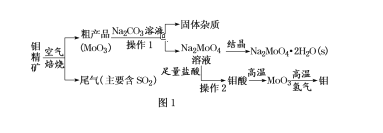
已知:钼酸微溶于水,可溶于液碱和氨水。回答下列问题:
(1)钼精矿焙烧时,每有1molMoS2反应,转移电子的物质的量为______。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是________,请你设计工业上除去该尾气的方法(写出两种“变废为宝”的方法和离子方程式):___________;___________。
(3)由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是_______。
(4)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol/L,c(SO42-)=0.04mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是_____。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
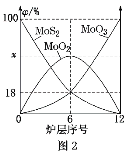
(5)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
①x=_____。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
D的单质:_________________;
A、B、E形成的化合物:________________;
D、E形成的化合物:___________________。
(2)A、B两元素组成的化合物A2B2存在的化学键是_______________。
(3)铝与A的最高价氧化物的水化物在水溶液中反应的离子方程式为:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com