
【题目】鹅去氧胆酸和胆烷酸都可以降低肝脏中的胆固醇,二者的转化关系如图,下列说法中正确的是
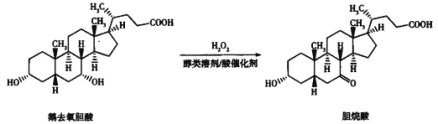
A. 二者互为同分异构体
B. 二者均能发生氧化反应和取代反应
C. 胆烷酸中所有碳原子可能处于同一平面内
D. 等物质的量的鹅去氧胆酸和胆烷酸与足量Na反应时,最多消耗Na的量相同
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
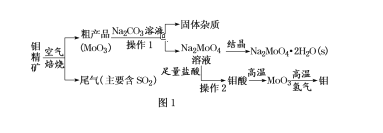
已知:钼酸微溶于水,可溶于液碱和氨水。回答下列问题:
(1)钼精矿焙烧时,每有1molMoS2反应,转移电子的物质的量为______。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是________,请你设计工业上除去该尾气的方法(写出两种“变废为宝”的方法和离子方程式):___________;___________。
(3)由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是_______。
(4)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol/L,c(SO42-)=0.04mol/L,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是_____。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
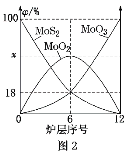
(5)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
①x=_____。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸镉[Cd(BrO3)2]常用于生产颜料和荧光粉。以镉铁矿(成分为CdO2、Fe2O3、FeO及少量的Al2O3和SiO2)为原料制备[Cd(BrO3)2]的流程如下:
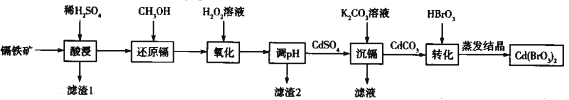
已知:Cd(SO4)2溶于水。
(1)Cd(BrO3)2中Cd的化合价为__________
(2)酸浸时,为了提高镉的浸取率可以采取的指施有__________(写出两种即可)。
(3)还原镉时,产生能使澄清石灰水变浑浊的气体,其发生反应的离于方程式为__________
(4)用H2O2溶液氧化时,氧化剂与还原剂的物质的量之比为__________
(5)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,调pH时,应调整的pH范为____,滤渣2的主要成分为_____(填化学式)。
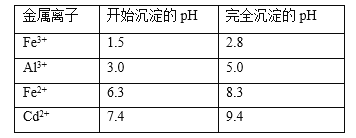
(6)实际工业生产中,有时还采用阳离子交换树脂法来测定沉镉后溶液中Cd2+的含量,其原理是: Cd2++2NaR=2Na++CdR2,其中NaR为阳离子交换树脂。常温下,将沉镉后的溶液(此时溶液pH=6)经过阳离子交换树脂后,测得溶液中的Na+比交换前增加了0.046g/L,则该条件下Cd(OH)2的Ksp值为____
(7)已知镉铁矿中CdO2的含量为72%,整个流程中镉元素的损耗率为8%,则2t该镉铁矿可制得Cd(BrO3)2(相对分子质量为368)_____Kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FFC电解法可由金属氧化物直接电解制备金属单质,西北稀有金属材料研究院利用此法成功电解制备钽粉(Ta),其原理如图所示。下列说法正确的是
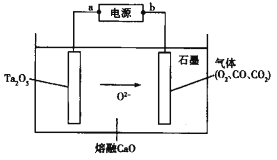
A. 该装置将化学能转化为电能
B. a极为电源的正极
C. Ta2O5极发生的电极反应为Ta2O5+10e—=2Ta+5O2—
D. 石墨电极上生成22.4 L O2,则电路中转移的电子数为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
D的单质:_________________;
A、B、E形成的化合物:________________;
D、E形成的化合物:___________________。
(2)A、B两元素组成的化合物A2B2存在的化学键是_______________。
(3)铝与A的最高价氧化物的水化物在水溶液中反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
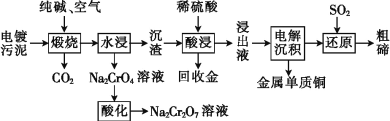
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2![]() 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为__________________。
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
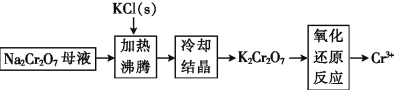
通过冷却结晶能析出大量K2Cr2O7的原因是__________________。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2![]() 被还原为Cr3+)
被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为________________。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。
(5)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少___?
(2)合金中镁铝的质量分数各是多少___、___?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com