
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( ) 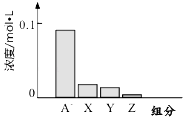
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH﹣ , Z表示H+
D.该混合溶液中:c(A﹣)+c(Y)=c(Na+)
【答案】D
【解析】解:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2OHA+OH﹣ , NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH﹣),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣ , Y表示HA,Z表示H+ , 溶液中存在物料守恒得到:c(Na+)=c(A﹣)+c(HA),A.一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,二者恰好反应:HA+NaOH=NaA+H2O,所得溶液为NaA溶液,溶液中中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2OHA+OH﹣ , NaA水解,HA为弱酸,故A错误;
B.c(Na+)>c(A﹣),说明NaA发生水解:A﹣+H2OHA+OH﹣ , 该混合液的pH>7,故B错误;
C.HA是弱电解质,则有c(A﹣)>c(OH﹣),c(OH﹣)除了水解产生的还有水电离的,因此c(OH﹣)>c(HA),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣ , Y表示HA,Z表示H+ , 故C错误;
D.溶液中存在物料守恒c(Na+)=c(A﹣)+c(HA),Y表示HA,得到c(A﹣)+c(Y)=c(Na+),故D正确;
故选D.
一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,HA+NaOH=NaA+H2O,所得溶液中A﹣浓度小于0.1mol/L,说明在溶液中存在A﹣+H2OHA+OH﹣ , NaA水解,HA为弱酸,NaA溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH﹣),所以有:c(Na+)=0.1mol/L>c(A﹣)>c(OH﹣)>c(HA)>c(H+),即X表示OH﹣ , Y表示HA,Z表示H+ , 溶液中存在物料守恒为:c(Na+)=c(A﹣)+c(HA).


科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是( )
①22gT2O含有电子数为10NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1mol Na2O2与CO2完全反应时转移电子数为2NA
④28g 硅晶体中含有2NA个Si﹣Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200mL,1mol/L Al2(SO4)3溶液中,Al3+和SO42﹣离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4NA .
A.①②③⑤⑧
B.②④⑥⑦⑧
C.①③⑤⑥⑦
D.①②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3 , 为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4 , 利用如图1所示的实验装置进行实验.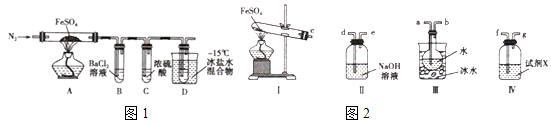
已知:①SO2熔点为﹣72℃,沸点为﹣10℃②SO3熔点为﹣16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为 , 同时有两种无色气体生成,写出该反应的化学方程式
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是 , 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品 .
实验二 探究高温分解 FeSO4生成的气体
(5)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c﹣
②试剂X的名称是
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A.3.2 g
B.4.0 g
C.4.2 g
D.4.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 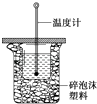
(1)从实验装置上看,图中尚缺少的一种玻璃用品是;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
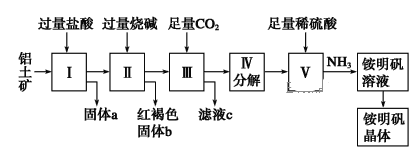
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 2mL0.5mo/L硅酸钠溶液中滴入适量盐酸制备硅酸胶体,所得胶粒数目为0.001NA
B. 1molNa2O2中含有的离子总数是4NA
C. 常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
D. 2.7gAl与足量氢氧化钠溶液反应,反应过程中转移的电子数目是0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种用CO2生产甲醇燃料的方法.已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
CH3OH(g)═CH3OH(l)△H=﹣bkJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣ckJmol﹣1;
则表示CH3OH(l)燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果不正确的是( )
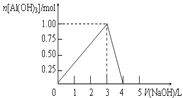
A. 反应过程中,沉淀最多时的质量为78g
B. 反应过程中,Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为3.5L
C. AlCl3溶液的浓度为2.0mol/L
D. 当V(NaOH)=4.0L时,得到的溶液中Na+、Cl-浓度一定不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com