
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3 , 为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4 , 利用如图1所示的实验装置进行实验.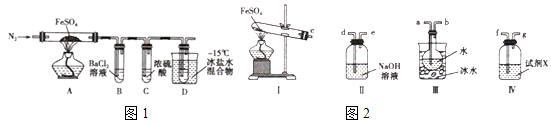
已知:①SO2熔点为﹣72℃,沸点为﹣10℃②SO3熔点为﹣16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为 , 同时有两种无色气体生成,写出该反应的化学方程式
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是 , 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品 .
实验二 探究高温分解 FeSO4生成的气体
(5)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c﹣
②试剂X的名称是
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量g.
【答案】
(1)排除装置中的空气
(2)红棕色;2FeSO4 ![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
(3)Fe2O3+6H+=2Fe3++3H2O;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
(4)在最后加一个盛碱石灰的干燥管或NaOH溶液
(5)a﹣b﹣f﹣g﹣d;品红溶液;![]()
【解析】解:(1)通入N2的目的是排除装置中的空气,所以答案是:排除装置中的空气;(2)B中有白色沉淀,可能为硫酸钡或者亚硫酸钡,有两种无色气体生成,则应为为二氧化硫和三氧化硫,硫元素化合价降低,则铁元素化合价升高为三氧化二铁,红棕色;所以答案是:红棕色;2FeSO4 ![]() Fe2O3+SO2↑+SO3↑;(3)Fe2O3与盐酸反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;将反应后所得溶液滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
Fe2O3+SO2↑+SO3↑;(3)Fe2O3与盐酸反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;将反应后所得溶液滴入D试管中,溶液铁离子被还原为变为浅绿色的亚铁离子,二氧化硫被氧化为硫酸根离子,该反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;
所以答案是:Fe2O3+6H+=2Fe3++3H2O;2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;(4)最后的D装置连接了空气,需排除空气,再D后加一个吸收二氧化碳和水的装置,以防与D中的二氧化硫反应;
所以答案是:在最后加一个盛碱石灰的干燥管或NaOH溶液;(5)①A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;
所以答案是:a﹣b﹣f﹣g﹣d;②SO2气体具有漂白性,可使品红溶液褪色,故D装置中装有品红溶液,检验二氧化硫的生成;
所以答案是:品红溶液;③第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止.若最终得到沉淀的质量为W g,沉淀为硫酸钡,依据硫元素守恒结合化学方程式定量关系可知,
2FeSO4~ | SO3~ | BaSO4 |
2 | 1 | |
n(FeSO4) |
|
已分解的硫酸亚铁质量为 ![]() ×2×152g/mol=
×2×152g/mol= ![]() g;
g;
所以答案是: ![]() .
.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】等质量的 SO2和 SO3相比较,下列结论正确的是( )
A. 它们的分子数目之比是 4:5
B. 它们的氧元素的质量之比为 2:3
C. 它们的物质的量之比为 5:4
D. 它们的密度之比为 5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( ) 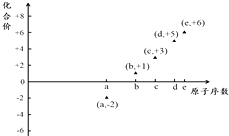
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b和c
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 天然存在的同位素,相互间保持一定的比率
B. 化合物分子中一定有非极性共价键
C. 同种元素的原子核内中子数相同而质子数不同
D. 周期表有18个横行7个纵行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的催化剂.某研究性学习小组设计了将粗MnO2(含有较多的 MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: 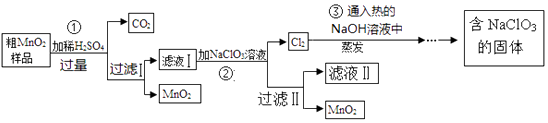
(1)检验操作A所得的MnO2是否洗涤干净的方法是 .
(2)第②步反应的离子反应方程式为 .
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、玻璃棒.
(4)上述流程中可用于循环使用的物质是(填化学式).
(5)MnO2不仅可作催化剂还可作氧化剂,写出1个用二氧化锰作氧化剂的化学反应方程式 .
(6)若粗MnO2样品的质量为24.28g,第①步反应后,经过滤得到18.35g MnO2 , 并收集到0.672LCO2(标准状况下),则样品中所含的MnO质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是人体生命活动必需的三大营养物质。以下叙述正确的是( )
A. 植物油不能使溴的四氯化碳溶液褪色
B. 葡萄糖能发生银镜反应和水解反应
C. 淀粉水解的最终产物是葡萄糖
D. 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是( ) 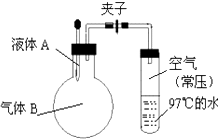
A.水、氯化氢
B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫
D.氢氧化钠溶液、一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( ) 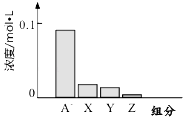
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH﹣ , Z表示H+
D.该混合溶液中:c(A﹣)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不正确的是
A. 用量筒量取 30mL 溶液 B. 用四氯化碳萃取碘水中的碘
C. 用托盘天平称取 2.5g 固体 D. 用温度计代替玻璃棒搅拌溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com