
【题目】等质量的 SO2和 SO3相比较,下列结论正确的是( )
A. 它们的分子数目之比是 4:5
B. 它们的氧元素的质量之比为 2:3
C. 它们的物质的量之比为 5:4
D. 它们的密度之比为 5:4
科目:高中化学 来源: 题型:
【题目】标准状况下有22.4L氯气和氢气的混合气体,在一密闭容器中使其反应,冷却后将此气体通入足量的氢氧化钠溶液中,共消耗1.5molNaOH,则原混合气体中氯气和氢气的体积比为
A. 2:1 B. 1:1 C. 1:2 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH3→CH3CH2Cl→CH2=CH2→CH3CH2OH的转化过程中,经过的反应是( )
A.取代→消去→加成
B.裂解→取代→消去
C.取代→消去→水解
D.取代→加成→氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
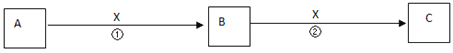
(1)若X是氧气,则A不可能______________A.CB.Si C.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)___________ 。检验B溶液中阳离子的操作方法是_________________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________
(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,则反应①的离子方程式为___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl(aq)
NH4Cl(aq)
D.MgCO3 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,下列叙述正确的是( )
①22gT2O含有电子数为10NA
②0.44gC3H8中含有的σ键总数目为0.1NA
③1mol Na2O2与CO2完全反应时转移电子数为2NA
④28g 硅晶体中含有2NA个Si﹣Si键
⑤11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑥200mL,1mol/L Al2(SO4)3溶液中,Al3+和SO42﹣离子数的总和是NA
⑦在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数为0.3NA
⑧O2和O3的混合物共6.4g,其中所含原子数一定为0.4NA .
A.①②③⑤⑧
B.②④⑥⑦⑧
C.①③⑤⑥⑦
D.①②④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3 , 为检验FeSO4高温分解的产物,并进行有关探究实验,回答下列问题:
实验一:高温分解FeSO4 , 利用如图1所示的实验装置进行实验.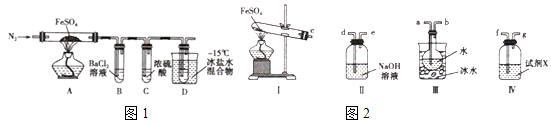
已知:①SO2熔点为﹣72℃,沸点为﹣10℃②SO3熔点为﹣16.8℃,沸点为44.8℃
(1)连接装置,检验气密性良好,放入药品,通入一段时间N2然后加热,通入N2的目的是
(2)隔绝空气加热至650℃,看到B中有白色沉淀,D试管中有无色液体,硬质玻璃管中的固体变为 , 同时有两种无色气体生成,写出该反应的化学方程式
(3)反应完毕后,停止加热冷却后,取硬质玻璃管中固体,加盐酸,反应的离子方程式是 , 将反应后所得溶液滴入D试管中,溶液变为浅绿色,该反应的离子方程式是
(4)有人认为该实验装置存在一定的缺陷,再增加一个装置即可弥补该缺陷,请指出添加的仪器位置及药品 .
实验二 探究高温分解 FeSO4生成的气体
(5)用如图2所示装置设计实验,验证高温分解FeSO4生成的气态物质
①按气流方向连接各仪器,用字母表示接口的连接顺序:c﹣
②试剂X的名称是
③充分反应后,利用装置 III中圆底烧瓶内混合物测定已分解的FeSO4 的质量,向圆底烧瓶中逐渐滴入氯化钡溶液,直到沉淀完全;然后过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重.若最终得到沉淀的质量为Wg,则已分解的FeSO4的质量g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com