
【题目】A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
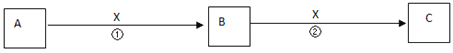
(1)若X是氧气,则A不可能______________A.CB.Si C.NaD.Mg
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)___________ 。检验B溶液中阳离子的操作方法是_________________。
(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,则反应②的离子方程式为________________
(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,则反应①的离子方程式为___________________ 。
【答案】 B D FeCl3 2Fe3++Fe═3Fe2+ 向溶液中滴加少量KSCN溶液,呈血红色 Al(OH)3+OH- =AlO2-+2H2O CO32-+H+ = HCO3-
【解析】(1)A、若A为C,C与O2反应生成CO,CO与O2继续反应生成CO2,选项A不选;B、若X为O2,A为Si,Si与O2反应生成SiO2,SiO2与O2不反应,选项B选;C、若A为Na,Na与O2先生成Na2O,Na2O与O2可继续反应生成Na2O2,选项C不选;D、若A为Mg,Mg与O2反应生成MgO,MgO与O2不反应,选项D选;答案选BD;(2)向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,若X是一种金属单质,由转化关系 ,X为变价金属铁,A为强氧化性物质,根据元素守恒知,A是Cl2,B是FeCl3,C是FeCl2;
,X为变价金属铁,A为强氧化性物质,根据元素守恒知,A是Cl2,B是FeCl3,C是FeCl2;
贮存FeCl2溶液时,Fe2+易被氧气氧化生成Fe3+,为防止Fe2+被氧化且不引进新的杂质,应该向氯化亚铁溶液中加入铁粉,2Fe3++Fe═3Fe2+;检验FeCl3溶液中阳离子的操作方法是:向溶液中滴加少量KSCN溶液,呈血红色;(3)若X是氢氧化钠溶液,A、B、C均为含铝元素的化合物,A为铝盐,B为Al(OH)3,C为偏铝酸盐;则反应②的离子方程式为: Al(OH)3+OH- =AlO2-+2H2O;(4)若X为盐酸,A、B、C均不含铝元素,且反应②有无色无味气体生成,A为偏铝酸盐,B为Al(OH)3,C为铝盐;则反应①的离子方程式为CO32-+H+ = HCO3-。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A.Na+、H+、Cl-、OH-B.Ag+、K+、Cl-、NO3–
C.Na+、H+、NO3– 、CO32-D.H+、Mg2+、SO42–、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O═3I2+6OH﹣
B.将过量SO2通入冷氨水中:SO2+NH3H2O═HSO3﹣+NH4+
C.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH﹣═NH3↑+H2O
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3﹣═Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的 SO2和 SO3相比较,下列结论正确的是( )
A. 它们的分子数目之比是 4:5
B. 它们的氧元素的质量之比为 2:3
C. 它们的物质的量之比为 5:4
D. 它们的密度之比为 5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
阴离子 | CO32﹣、SiO32﹣、[Al(OH)4]﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
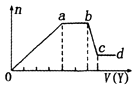
A.若Y是盐酸,则X中一定含有CO32﹣、SiO32﹣、[Al(OH)4]﹣和NH4+
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl﹣
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH﹣═NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( ) 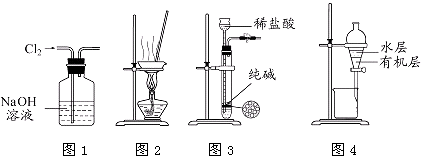
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的催化剂.某研究性学习小组设计了将粗MnO2(含有较多的 MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: 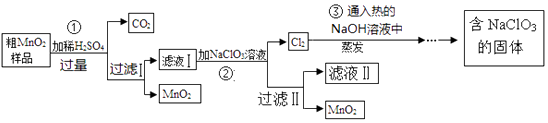
(1)检验操作A所得的MnO2是否洗涤干净的方法是 .
(2)第②步反应的离子反应方程式为 .
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、玻璃棒.
(4)上述流程中可用于循环使用的物质是(填化学式).
(5)MnO2不仅可作催化剂还可作氧化剂,写出1个用二氧化锰作氧化剂的化学反应方程式 .
(6)若粗MnO2样品的质量为24.28g,第①步反应后,经过滤得到18.35g MnO2 , 并收集到0.672LCO2(标准状况下),则样品中所含的MnO质量为g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com