
【题目】MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:

下列说法错误的是
A. 装置I烧瓶中放入的药品X为铜屑
B. 装置II中用“多孔球泡”可增大SO2的吸收速率
C. 装置III用于吸收未反应的SO2
D. 用装置II反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥的过程
科目:高中化学 来源: 题型:
【题目】已知:在36 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且知C(s) +1/2O2(g) = CO(g) △H = -110.5 kJ/mol CO(g) +1/2O2(g) = CO2(g) △H = -283 kJ/mol,下列说法错误的是
A. 与这些碳完全燃烧相比,碳不完全燃烧损失的热量是 283kJ
B. CO2(g)= C(s) + O2(g) △H = +393.5 kJ/mol
C. 3mol C(s)与2mol O2(g)完全反应放出的热量为614.5 kJ
D. 已知相关的化学键键能数据如下
化学键 | H—H | C—O |
| H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
则CO(g)+2H2(g)![]() CH3OH(g) ΔH= +99 kJ/mol
CH3OH(g) ΔH= +99 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 mol/L NaOH溶液滴定未知浓度的盐酸溶液,操作可分解为如下几步:
A.用蒸馏水洗干净滴定管;B. 用待测定的溶液润洗酸式滴定管;C.用酸式滴定管取稀盐酸20.00 mL,注入锥形瓶中,加入酚酞;D.另取锥形瓶,再重复操作一次;E.检查滴定管是否漏水;F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________。
(2)操作F中应该选择图中________滴定管(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应观察________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是____________________________。
(4)滴定结果如表所示:
滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A. 碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B. 滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C. 滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D. 达到滴定终点时,仰视溶液凹液面最低点读数
E. 滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________mol/L。
(6)如果准确移取20.00 mL 0.1000 mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应C(s)+H2O(g) ![]() CO(g)+H2(g) △H>0 达到平衡,下列叙述正确的是
CO(g)+H2(g) △H>0 达到平衡,下列叙述正确的是
A. 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 加入固体炭,平衡向正反应方向移动
C. 加入水蒸气,平衡向逆反应方向移动
D. 扩大容器的容积,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题
甲 乙
乙
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
E.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的形式主要是:甲为____;乙为_____。
(3)若反应过程中有![]() 电子发生转移,则生成的氢气在标况下的体积为__________
电子发生转移,则生成的氢气在标况下的体积为__________
(4)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是:______
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为短周期的一部分,Y原子最外层电子数是其电子层数的 2倍,下列说法正确的是

A.Y的氢化物比 Z的氢化物稳定
B.原子半径大小为Z>Y>R>X
C.Y、R形成的化合物 YR2能使酸性 KMnO4溶液褪色
D.四种元素中最高价氧化物的水化物酸性最强的是 Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
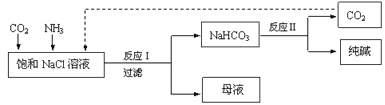
有关说法错误的是
A.反应Ⅰ原理为CO2 + NH3+ NaCl + H2O → NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A.硫的原子结构示意图: 
B.NH4Br的电子式:
C.中子数为20的氩原子:![]() Ar
Ar
D.Be2+中的质子数和电子数之比为:2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是

A.发生的反应为:2Na+Cl2![]() 2NaCl
2NaCl
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C.钠着火燃烧产生苍白色火焰
D.若在棉花球外沿滴一滴石蕊溶液,可根据颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com