
����Ŀ����֪��pAg=-lgc(AgCl)��Ksp(AgCl) =1��10-12����ͼ����10mLAgNO3��Һ������0.1mol��L-1��NaCl��Һʱ����Һ��pAg���ż���NaCl��Һ���������λmL)�仯��ͼ��ʵ�ߣ�������ͼ���������н�����ȷ����[��ʾ��Ksp(AgCl)>Ksp(AgI)]
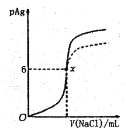
A.ԭAgNO3��Һ�����ʵ���Ũ��Ϊ0.1mol��L-1
B.ͼ��x���ʾ��Һ��c(Ag+)=c(Cl-)
C.ͼ��x�������Ϊ��10��6)
D.��0.1mol��L-1 �� NaCl���� 0.1 mol��L-1 NaI����ͼ�����յ���Ϊ���߲���
���𰸡�B
��������
A. ͼ��ԭ��pAg��0����Ag+��Ũ��Ϊ��c(Ag+)��100mol/L =1mol/L����ԭAgNO3��Һ�����ʵ���Ũ��Ϊ1mol/L��A�����
B. x��c(Ag+)��106mol/L����Һ��c(Cl)=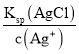 =106mol/L��������Һ��c(Ag+)��c(Cl)��B����ȷ��
=106mol/L��������Һ��c(Ag+)��c(Cl)��B����ȷ��
C. x��c(Ag+)��c(Cl)��106mol/L��һ����Ϊ��Һ������Ũ��С��105mol/L����������ȫ����AgNO3��NaClǡ�÷�Ӧ��n(NaCl)��n(AgNO3)��0.01L��1mol/L��0.01mol������V(NaCl)��100mL����x�������Ϊ(100��6)��C�����
D. ��AgCl��ȣ��⻯����Ksp(AgI)��С������0.1mol/L��NaCl����0.1mol/LNaI������Һ��c(Ag+)��С����pAg����ͼ����D�����
��ѡB��


 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25mL 0.1mol��L-1NaOH��Һ����μ���0.2mol��L-1CH3COOH��Һ����ҺpH�仯������ͼ��ʾ�������й�����Ũ�ȵıȽ���ȷ����

A.��A��B����һ��(����A��B��)����Һ�п�����c(Na+)>c(CH3COO��)>c(OH��)>c(H+)
B.��B�㣬a>12.5������c(Na+)=c(CH3COO��)=c(OH��)=c(H+)
C.��C�㣬c(CH3COO��)>c(Na+)>c(OH��)>c(H+)
D.��D�㣬c(CH3COO��)+c(CH3COOH)=c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������֤����Ӧ![]()
![]() �Ѵﵽƽ��״̬����
�Ѵﵽƽ��״̬����![]()
A.1��![]() �ֽ��ͬʱ����3��
�ֽ��ͬʱ����3��![]() ���γ�
���γ�
B.1��![]() �ֽ��ͬʱ����3��
�ֽ��ͬʱ����3��![]() �ķֽ�
�ķֽ�
C.1��![]() �ֽ��ͬʱ����1��
�ֽ��ͬʱ����1��![]() �ķֽ�
�ķֽ�
D.1��![]() �ֽ��ͬʱ����2��
�ֽ��ͬʱ����2��![]() ���γ�
���γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����100mL 1molL��1H2SO3��Һ������1molL��1��NaOH��Һ���������ʵķֲ������ģ�ƽ��ʱij���ʵ�Ũ���������Ũ��֮�͵ıȣ���pH�Ĺ�ϵ��ͼ��ʾ����֪��pKs=��lgK��25��ʱ��H2SO3��pKa1=1.85��pKa2=7.19��������˵������ȷ���ǣ� ��
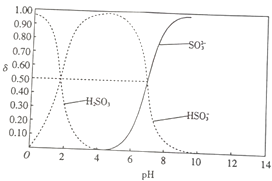
A��pH=1.85ʱ��c��H2SO3��=c��HSO3����
B��pH=6ʱ��c��Na+����c��HSO3������c��SO32����
C��pH=7.19ʱ��c��Na+��+c��H+��=c��HSO3����+2c��SO3����+c��OH����
D������150mLNaOH��Һʱ��3c��Na+��=2c��H2SO3��+2c��HSO3����+2c��SO32����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)��¶�ڿ��������ױ�ը����������������ȼ�ϵ����һ������ĵ�أ���������������ת���ʸߡ���������Ⱦ���ص㣬�乤��ԭ����ͼ��ʾ������������ȷ����(����)

A. ��ع���ʱ������������pH����
B. ������1 mol O2ʱ����2 mol Na���ɼײ����Ҳ�Ǩ��
C. ������ӦΪ4OH����N2H4��4e��===N2����4H2O
D. ��ȥ�������ӽ���Ĥ�����Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ�����������ȷ����

A. ͼ�ٿ��Ա�ʾ�ھ��������з���N2��H2���ڴ��ϳɰ��Ĺ����У�N2��ת������ʱ��ı仯����
B. ͼ�ڿ��Ա�ʾ��T����ܱ������У���Ӧ2AgBr(s)![]() 2Ag(s)+Br2(g)�ﵽƽ�⣬��ʱ�ٿ�ʼ�����������������������������AgBr(s)ʣ��ʱ������ѹǿ�ı仯����
2Ag(s)+Br2(g)�ﵽƽ�⣬��ʱ�ٿ�ʼ�����������������������������AgBr(s)ʣ��ʱ������ѹǿ�ı仯����
C. ͼ�ۿ��Ա�ʾ�������pH��̼������Һ�ʹ�������Һ��ˮϡ������pH�ı仯����
D. ͼ�ܿ��Ա�ʾ�Ȼ������廯��������Һ�������Ϻ�����û����Һ�м���ŨAgNO3��Һʱ�����ɳ��������ʵ��������AgNO3��Һ����ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ˮ���ص��ǣ� ��
A.����ʳ��ˮʹ�����Ի�ɫ
B.FeCl3��Һ�������ɵõ�Fe2O3
C.NH4Cl��Һ������
D.Na2CO3������Һ����ʢװ�ڲ��������Լ�ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ָ�Ч������Ư������Ҫ�����ġ����顢ֽ����Ư�ס�NaClO2����Һ�п�����ClO2��HClO2��ClO2-��Cl-�����ֺ����������ⶨ��25��ʱ����ֺ�����pH�仯�����ͼ��ʾ��Cl-û�л������������з�������ȷ����
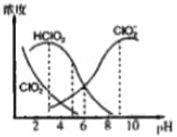
A. ���������ڼ��������½��ȶ�
B. 25��ʱ��HClO2�ĵ���ƽ�ⳣ������ֵKa=10-6
C. 25�棬pH=3ʱNaClO2��Һ��c(Na+)+c(H+)=c(ClO2-)+c(OH-)
D. ��Ũ�Ⱦ�Ϊ0.1mol/L��HClO2��Һ��NaClO2��Һ�������Ϻ�������Һ�����ԣ���Һ���й�����Ũ���ɴ�С��˳��Ϊc(ClO2-)>c(Na+)>c(HClO2)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)��1.56��10��10��Ksp(AgBr)��7.7��10��13��Ksp(Ag2CrO4)��9.0��10��12��ij��Һ�к���Cl����Br����CrO42����Ũ�Ⱦ�Ϊ0.010 mol��L��1�������Һ����μ���0.010 mol��L��1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ(����)
A.Cl����Br����CrO42��B.CrO42����Br����Cl��C.Br����Cl����CrO42�� D.Br����CrO42����Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com