
| A、相同条件下,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大 |
| B、0.2 mol?L-1NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③NH3?H2O、④CH3COONH4,c(NH)由大到小的顺序是:②>①>④>③ |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:

A、 、HCHO和 、HCHO和 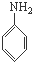 |
B、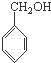 、CH3OH和 、CH3OH和 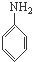 |
C、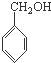 、HCHO和 、HCHO和 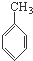 |
D、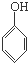 、CH3CHO和 、CH3CHO和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
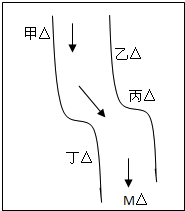 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解稀硫酸,实质上是电解水,故溶液酸性不变 |
| B、电解池内发生的反应均为自发进行的氧化还原反应 |
| C、电解硫酸钠溶液,在阴极和阳极上析出产物的物质的量之比为1:2 |
| D、电解氯化铜溶液,在阴极和阳极上析出产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:3s23p1 Y:3s23p5 |
| B、X:2s22p3 Y:2s22p5 |
| C、X:3s23p1 Y:3s23p4 |
| D、X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 mol?L-1 | K1=4.3×10-7 mol?L-1 K2=5.6×10-11 mol?L-1 | K1=9.1×10-8 mol?L-1 K2=1.1×10-12 mol?L-1 | K1=7.5×10-3 mol?L-1 K2=6.2×10-8 mol?L-1 K3=2.2×10-13 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com