
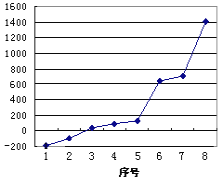
【题目】(1)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表___(填元素符号);其中电负性最大的是___(填图中的序号)。
(2)请写出比元素1的原子序数大8的元素的基态原子电子排布式___。
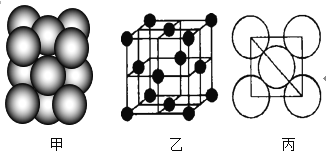
(3)元素7的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知7的原子半径为d cm,NA代表阿伏加德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为___,一个晶胞中7原子的数目为___;
②该晶体的密度为___ g/cm3(用字母表示)。
【答案】Si 2 1s22s22p63s23p63d64s2 12 4 ![]()
【解析】
(1)第三周期中晶体硅为原子晶体,单质的熔点最高;同一周期自左而右元素电负性增大,故Cl元素电负性最大,氯气、氩气为气体,氯气相对分子质量更多,分子间作用力更强,故氯气的熔点高于氩气的;
(2)根据(1)分析可知“1”表示的是18号元素Ar,则比Ar大8号的元素是26号Fe元素,根据构造原理书写其核外电子排布式;
(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子为12个面共用;根据均摊法计算晶胞中含有原子数目;
②由图丙可知,正方形对角线长度为4d cm,进而确定晶胞的体积,再根据晶胞含有原子数目计算晶胞的质量,再根据ρ=![]() 计算密度。
计算密度。
(1)第三周期中晶体硅为原子晶体,原子之间以共价键结合形成网状,断裂消耗很高能量,因此硅单质的熔点最高,序号“8”代表Si元素;同一周期元素,从左向右元素的电负性逐渐增大,故Cl元素电负性最大,氯气、氩气为气体,由于氯气相对分子质量更多,分子间作用力更强,故氯气的熔点高于氩气的,故电负性最大的Cl元素的代表序号为2;
(2)比1表示的是18号Ar元素,则比Ar多8的元素是Fe,其基态原子核外电子排布式是1s22s22p63s23p63d64s2;
(3)①由图可知,晶胞为面心立方堆积,以顶点的原子分析,一个晶胞中含有3个位于面心的原子,通过一个顶点有8个晶胞,每个面心原子同时属于2个晶胞,故1个顶点原子的配位数为8×3×![]() =12个;晶胞中含有的该原子数目=8×
=12个;晶胞中含有的该原子数目=8×![]() +6×
+6×![]() =4;
=4;
②由图丙可知,正方形对角线长度为4d cm,故立方体的棱长为:![]() ×4d cm=2
×4d cm=2![]() d cm,晶胞体积为V=(
d cm,晶胞体积为V=(![]() )3=16
)3=16![]() d cm3,晶胞中含有原子数目=8×
d cm3,晶胞中含有原子数目=8×![]() +6×
+6×![]() =4,相对原子质量为M,故晶胞的质量=4×
=4,相对原子质量为M,故晶胞的质量=4×![]() g,故晶体的密度=ρ=
g,故晶体的密度=ρ=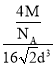 g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2在该反应中( )
A.硫元素既被氧化又被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mol电子
D.相同条件下,每吸收10L SO2就会放出2.5LCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)积极保护生态环境可实现人与自然的和谐共处。
①下列做法会加剧温室效应的是__________(填字母)。
a.植树造林 b.燃煤供暖 c.风力发电
②下列防治“白色污染”的正确方法是_____________(填字母)。
a.使用可降解塑料 b.露天焚烧废旧塑料 c.直接填埋废旧塑料
③为减轻大气污染,多个城市已禁止燃放烟花爆竹。“禁止燃放烟花爆竹”的标识是_____(填字母)。

(2)合理使用化学知识可提高人们的生活质量。
某品牌牙膏的成分有甘油、山梨酸钾、氟化钠等。
①在上述牙膏成分中,属于防腐剂的是_______________。
②甘油的结构简式为____________;油脂水解可生成甘油和_____________。
③氟化钠(NaF)可与牙齿中的羟基磷酸钙[Ca5(PO4)3OH]反应,生成更难溶的氟磷酸钙[Ca5(PO4)3F],从而达到防治龋齿的目的。写出该反应的化学方程式:____________________。
(3)创新发展材料技术科推动人类社会的进步。
①石墨烯(见下图)可用作太阳能电池的电极,这里主要利用了石墨烯的______________性。

②基础工程建设中常用到水泥、玻璃、钢材等。生成水泥和玻璃都用到的原料是__________;在钢材中添加铬、镍等元素的目的是___________。
③新型战斗机常用纳米SiC粉体作为吸波材料。高温下焦炭和石英反应可制得SiC,石英的化学式为________________;高温分解Si(CH3)2Cl2也可制得SiC,同时还生成CH4和一种常见酸性气体,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图填空。
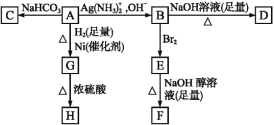
已知H是环状化合物C4H6O2,F的碳原子都在一条直线上。
(1)化合物A含有的官能团是 。
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变成F,由E转变成F时发生两种反应,其反应类型分别是 。
(3)D的结构简式是 。
(4)1 mol A与2 mol H2反应生成1 mol G,其反应方程式是 。
(5)与A具有相同官能团的A的同分异构体的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是 ( )
A. 元素电负性越大的原子,吸引电子的能力越强
B. 在![]() 和
和![]() 中都存在配位键
中都存在配位键
C. SO2、SO3都是极性分子
D. 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。完成下列填空:
(1)上述烟气处理过程中涉及到的化学物质组成元素中,属于第三周期元素的是___;写出N的核外电子排布式___。
(2)已知SO2分子的空间构型为折线形,则SO2为___(选填“极性”、“非极性”)分子。
(3)将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时问后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计):
离子 | Na+ | SO42- | NO3- | OH- | Cl- |
浓度/(mol·L-1) | 5.5×10-3 | 8.5×10-4 | y | 2.0×10-4 | 3.4×10-3 |
①反应后溶液pH___7,表中y=___mol·L-1。
②写出NaClO2溶液吸收SO2的离子方程式___。
(4)烟气中的SO2还可采用氨法脱硫除去,其反应原理可用如图表示。
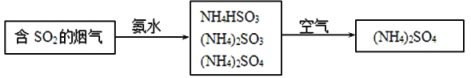
①写出SO2跟氨水反应生成NH4HSO3的化学方程式___。
②(NH4)2SO4溶液中浓度最大的离子是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1, I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1, I4=10 540 kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式_________。
(2)比较BA2-和BA3的键角∠ABA的大小:BA2-____(填“>”“=”或“<”)BA3,请用价层电子对互斥理论解释:____________。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() 该同学所画的电子排布图违背了_______。
该同学所画的电子排布图违背了_______。
(4)E位于_____族_____区,价电子排布式为______。
(5)检验D元素的方法是______,请用原子结构的知识解释产生此现象的原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的名称__________,B的键线式 _________,C的结构简式 _____________。
(2)在①~⑥的各步反应中,属于取代反应的有_________,属于加成反应的有________。
(3)反应③的化学方程式是_____________________________________________________
(4)反应④的化学方程式是_____________________________________________________
(5)反应⑥的化学方程式是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com