
����Ŀ���������Ƿ��Ϳɵ����ᣬΪ�о�����ķ�����ɺͽṹ������������ʵ�飺
��1����ȡ����0.90g����ij��״����ʹ����ȫ��������ͬ״����ͬ�����H2������Ϊ0.02g�����������Է�������Ϊ ��
��2��������������������������ȼ��ֻ����CO2��H2O��g������ȫ������ʯ������ʱ����ʯ�ҵ���������1.86g�������˲���ͨ�����ʯ��ˮ�У������3.00g��ɫ������������ķ���ʽΪ ��
��3����ȡ0.90g���ᣬ�������������Ʒ�Ӧ������H2224mL����״��������������̼�����Ʒ�Ӧ������224mLCO2����״������������Ľṹ��ʽ����Ϊ�� ��
��4���������Ƿ���ֻ�������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ ��
��5�����������ᡢ�������Ҵ����ܷ���������Ӧ����ͬ�������������ɵ�������������л����������Ϊ ��
���𰸡�
��1��90
��2��C3H6O3
��3��CH2��OH��CH2COOH��![]()
��4��C6H12O6 ![]() 2CH3CH��OH��COOH
2CH3CH��OH��COOH
��5��66��59
���������⣺��1����Է�������֮�ȵ����ܶ�֮�ȣ���Mr�����ᣩ��2=0.9g��0.02g����Mr�����ᣩ=90���ʴ�Ϊ��90����2��3.00g��ɫ����Ϊ̼��ƣ����ʵ���Ϊ ![]() =0.03mol����������ʵ���Ϊ
=0.03mol����������ʵ���Ϊ ![]() =0.01mol��0.01mol������ȫȼ������CO2 0.03 mol�������������Cԭ����ĿΪ
=0.01mol��0.01mol������ȫȼ������CO2 0.03 mol�������������Cԭ����ĿΪ ![]() =3������H2O������=1.86g��0.03mol��44g/mol=0.54g�������ʵ���Ϊ0.03 mol�����������Hԭ����ĿΪ
=3������H2O������=1.86g��0.03mol��44g/mol=0.54g�������ʵ���Ϊ0.03 mol�����������Hԭ����ĿΪ ![]() =6�������������Oԭ����ĿΪ
=6�������������Oԭ����ĿΪ ![]() =3����������ķ���ʽΪC3H6O3 ��
=3����������ķ���ʽΪC3H6O3 ��
�ʴ�Ϊ��C3H6O3����3����������ʵ���Ϊ ![]() =0.01mol����̼���Ʒ�Ӧ���ɶ�����̼Ϊ
=0.01mol����̼���Ʒ�Ӧ���ɶ�����̼Ϊ ![]() =0.005mol������2��COOH��CO2������������Ӻ���1����COOH�����Ʒ�Ӧ��������Ϊ
=0.005mol������2��COOH��CO2������������Ӻ���1����COOH�����Ʒ�Ӧ��������Ϊ ![]() =0.01mol��2��COOH��H2����2��OH��H2������֪������ӻ�����һ����OH����֪����Ľṹ��ʽ������CH2��OH��CH2COOH��
=0.01mol��2��COOH��H2����2��OH��H2������֪������ӻ�����һ����OH����֪����Ľṹ��ʽ������CH2��OH��CH2COOH�� ![]() ��
��
�ʴ�Ϊ��CH2��OH��CH2COOH�� ![]() ����4���������Ƿ���ֻ�������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ��C6H12O6
����4���������Ƿ���ֻ�������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ��C6H12O6 ![]() 2CH3CH��OH��COOH��C6H12O6 �������ǣ���
2CH3CH��OH��COOH��C6H12O6 �������ǣ���
�ʴ�Ϊ��C6H12O6 ![]() 2CH3CH��OH��COOH����5���������������ɵ�������Է�������Ϊ60+90��18=132���������Ҵ����ɵ�������Է�������Ϊ46+90��18=118����ͬ�������������ɵ�������������л����������Ϊ��132��118=66��59��
2CH3CH��OH��COOH����5���������������ɵ�������Է�������Ϊ60+90��18=132���������Ҵ����ɵ�������Է�������Ϊ46+90��18=118����ͬ�������������ɵ�������������л����������Ϊ��132��118=66��59��
�ʴ�Ϊ��66��59��
��1����Է�������֮�ȵ������ܶ�֮�ȣ���2��3.00g��ɫ����Ϊ̼��ƣ���ʯ������Ϊ�������ɶ�����̼��ˮ�������������������̼����������ʵ�������������ȼ������ˮ������������ԭ���غ���������C��Hԭ����Ŀ���ٸ�����Է�����������Oԭ����Ŀ������ȷ������ʽ����3������Ϊ0.01mol����̼���Ʒ�Ӧ���ɶ�����̼Ϊ0.005mol������̼��˵��������Ӻ���1����COOH�����Ʒ�Ӧ����0.01mol��������˵��������һ����OH����Ϸ���ʽ��д���ܵĽṹ��ʽ����4����ϣ�3��������Ŀ��ܽṹ��д����ʽ����5����ͬ�������������ɵ�������������л���������ȵ������ֲ����Ħ������֮�ȣ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶���Ҫ������;����������_______��_______��_______��������Ҫ��_______����̬���ʺ�_______��Ŀǰ������ʹ��������һ�ַ�����_______����_______��Ҫ���е����ֻ��������ϵĻ�ѧ���ϳƸ��Ϸ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ϩ������������ȷ����
����ϩ����ˮ��ɵ��Ҵ� ����ϩ�����Ӿ۷�Ӧ���ɾ���ϩ �������л�����ϩ������ˮϴ����ȥ������ϩ����ɫ��������ζ��������ˮ������
A. �Т� B. �ٺ͢� C. �ں͢� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ԭ����ǰѵ���ת��Ϊ��ѧ�ܵ�װ�� B. ��ѧ��Ӧ�������仯�Ĵ�С�뷴Ӧ�������������
C. Ԫ�����ڱ��еڢ�A��ȫ���ǽ���Ԫ�� D. ԭ����е��������������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ͼʾװ���Ʊ�KC1O��Һ������KOH��Fe(NO3)3��Һ��Ӧ�Ʊ��{Ч��ˮ��K2FeO4��

<��������>O2��KOH��Һ��20�����·�Ӧ����KC1O���ڽϸ��¶���������KC1O3��K2FeO4������ˮ������ŨKOH��Һ����0����5����ǿ������Һ�н��ȶ���
(1)����a��������___________��װ��A�з�Ӧ�����ӷ���ʽΪ___________________��
װ��C��������ƿ���ڱ�ˮԡ�е�Ŀ����_______________��
(2)װ��B���յ�������___________��װ��D��������____________________��
(3)C�еõ�����KC1O��������ƿ�ϵĵ���ȡ�£����μ���KOH��Һ��Fe(NO3)3��Һ��ˮԡ���Ʒ�Ӧ�¶�Ϊ25��������1.5 h����Һ��Ϊ�Ϻ�ɫ(��K2FeO4)���÷�Ӧ�����ӷ���ʽΪ________________���ټ��뱥��KOH��Һ����ȴ��0����5�������Ϻ�ɫ���壬���ˣ��õ�K2FeO4�ֲ�Ʒ��
(4)K2FeO4�ֲ�Ʒ����Fe(OH)3��KC1�����ʣ����ᴿ����Ϊ��
�ٽ�һ������K2FeO4�ֲ�Ʒ�������3 mol/LKOH��Һ�С�
�ڹ��ˡ�
��____________________��
�ܽ��衢���á����ˣ����Ҵ�ϴ��2��3�Σ�
������ո������и��
(5)��ȡ�ᴿ���K2FeO4��Ʒ0.2200 g���ձ���������ǿ����NaCr(OH)��Һ����Ӧ���ټ�ϡH2SO4������Һ��ǿ���������250 mL��Һ��ȡ��25.00 mL������ƿ����0.01000 mol/L��(NH4)2Fe(SO4)2��Һ�ζ����յ����ظ�����2����ƽ������(NH4)2Fe(SO4)2��Һ30.00 mL���漰��Ҫ��ӦΪ��
Cr(OH)4-+FeO42- =Fe(OH)3��+CrO42-+OH-
2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
���K2FeO4��Ʒ�Ĵ���Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(LiMn2O4)����Ϊ����ӵ�ص��������ϡ���ҵ���������̿����պ���������SO2 ��O2���Ʊ�����ﮣ������������£�
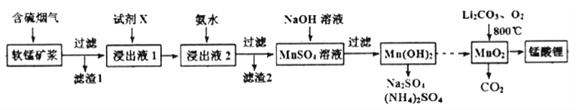
��֪�������̿���Ҫ�ɷ�ΪMnO2��������Fe2O3��FeO��Al2O3��SiO2�����ʡ�
�����̿������պ��������Ĺ�������������ǿ��
�۲����������������ص���ҺpH���±���
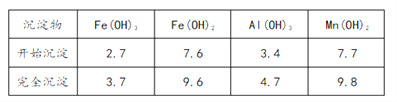
��1����֪��
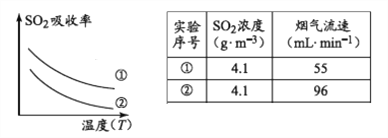
���д�ʩ�����SO2�����ʵ���__________������ţ�
a.����ͨ�뺬���������¶� b.����ͨ�뺬���������¶�
c.�������̿Ľ����� d.��Сͨ�뺬������������
��2�������Լ�X����߲�Ʒ���ȣ���X������_____________���ѧʽ��
��3���Ӱ�ˮ����ҺpH��5��6֮�䣬Ŀ����_______________��
��4������﮿ɳ���ص��ܷ�ӦʽΪ��Li1-xMnO2+LixC ![]() LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
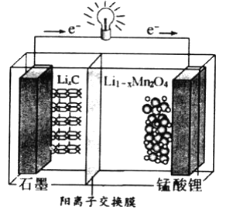
�ٷŵ�ʱ����ص�������ӦʽΪ__________________
�ڳ��ʱ����ת��1mole-����ʯī�缫������__________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.��28 gCO������ͬ��������C2H4������һ����28 g
B.1 molAl 3+���еĺ��������Ϊ3NA
C.���³�ѹ�£�1 mol���麬�е�ԭ����Ϊ5NA
D.���³�ѹ�£�1 molL�������������22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ijЩ���ʿ���NH3��H2O��NH4 +��H3O+��OH-��NH2-��N3����O2���������ƣ��ݴ��ж����з�Ӧʽ�в���ȷ����
A. 2Na+2NH3===2NaNH2+H2��
B. 3CaO+4NH4Cl===Ca3N2+2NH3��+3H2O+4HCl
C. 3Mg(NH2)2![]() Mg3N2+4NH3��
Mg3N2+4NH3��
D. NH4Cl+NaNH2===NaCl+2NH3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com