
【题目】氮及其化合物在生活和生产中应用广泛。
I.(1)N2O是一种典型的温空气体,在一定条件下,其分解的化学方程式为:2N2O(g)==2N2(g) +O2(g) △H________________。
(2)已知一定条件下有下列反应:
①2N2O5(g)![]() 4NO2(g)+ O2(g) △H1
4NO2(g)+ O2(g) △H1
②2NO2(g)![]() 2NO(g)+ O2(g) △H2
2NO(g)+ O2(g) △H2
③2NaOH(aq)+ N2O5(g)![]() 2NaNO3(aq)+H2O(1) △H3
2NaNO3(aq)+H2O(1) △H3
写出NO与O2的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式_____________________________。在容积为2L 的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应①、②,若达到平衡状态后O2 为1.00mol,NO2为0.400mol,则T℃时反应①的平衡常数的值为_______________________。
II.联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(3)联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式_______________。
(4)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3:2,则该分解反应的化学方程式为_____________________________________。
(5)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g) +4NO(g) +O2(g) ![]() 4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。
4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。

A.在催化剂甲作用下,图中Y点处(210℃) NO的转化率一定不是该温度下的平衡转化率
B.在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是催化剂活性降低
C.300℃时,NO的平衡转化率M点高于Z点的原因是乙催化剂催化效率高
D.其他条件不变,增加NH3的浓度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
III.NH3是一种重要的化工原料。
(6)NH3和Cr2O3 固体高温下可以制备多功能材料CrN晶体,其反应为Cr2O3 (s) +2NH3(g) ![]() 2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
【答案】 一定不能 因为逆反应的△S<0,△H>0,所以逆反应不能自发进行 4NO(g) +3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1) △H=2△H3-△H1-2△H2 8.00×10-2 N2H4+2H+=N2H62+ 7N2H4![]() 8NH3+2H2 +3N2 CD 提高NH3流量相当于使c(NH3)增大,若反应未达到平衡,反应物浓度增大反应速率加快,一定时间内Cr2O3转化率提高,若反应达创平衡,反应物浓度增加且带走H2O,都使平衡正移,提高Cr2O3转化率。
8NH3+2H2 +3N2 CD 提高NH3流量相当于使c(NH3)增大,若反应未达到平衡,反应物浓度增大反应速率加快,一定时间内Cr2O3转化率提高,若反应达创平衡,反应物浓度增加且带走H2O,都使平衡正移,提高Cr2O3转化率。
【解析】I.(1) 该反应2N2O(g)==2N2(g)+O2(g) △H2(g)+O2(g)= 2N2O(g) △H>O,△S<0,反应一定不能自发进行;正确答案:一定不能;因为逆反应的△S<0,△H>0,所以逆反应不能自发进行。
(2)根据盖斯定律:③×2-(①+②×2)可得4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1),△H=2△H3-△H1-2△H2;
根据第一个反应,设反应生成氧气xmol,进行如下计算:
2N2O5(g) ![]() 4NO2(g)+ O2(g)
4NO2(g)+ O2(g)
起始量 1 0 0
变化量 2x 4x x
平衡量 1-2x 4x x
根据第二个反应,设反应生成氧气ymol ,进行如下计算:
2NO2(g) ![]() 2NO(g)+ O2(g)
2NO(g)+ O2(g)
起始量 4x 0 x
变化量 2y 2y y
平衡量 4x -2y 2y y
若达到平衡状态后O2为1.00mol,NO2为0.400mol,则y=1.00mol,4x-2y=0.4,x=0.6 mol,所以针对于第一个反应来讲:平衡时各物质浓度分别为:c(N2O5)=0.8/2=0.4mol/L, c(NO2)=2.4/2=1.2 mol/L, c(O2)=0.6/2=0.3 mol/L,根据平衡常数K= c(O2)×c4(NO2)/ c2(N2O5)=0.3×1.24/0.42=8.00×10-2;正确答案:4NO(g)+3O2(g)+4NaOH(aq)=4NaNO3(aq)+2H2O(1)△H=2△H3-△H1-2△H2;8.00×10-2。
II. (3)联氨为二元弱碱,电离方程式为:N2H4+H2O![]() N2H+5+OH-,N2H+5 +H2O
N2H+5+OH-,N2H+5 +H2O![]() N2H2+6+ OH-,加入过量盐酸后,中和了氢氧根离子,平衡右移,生成了N2H2+6,联氨与过量盐酸反应的离子方程式N2H4+2H+=N2H62+;正确答案:N2H4+2H+=N2H62+。
N2H2+6+ OH-,加入过量盐酸后,中和了氢氧根离子,平衡右移,生成了N2H2+6,联氨与过量盐酸反应的离子方程式N2H4+2H+=N2H62+;正确答案:N2H4+2H+=N2H62+。
(4)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3:2,则该分解反应的化学方程式为7N2H4![]() 8NH3+2H2+3N2;正确答案:7N2H4
8NH3+2H2+3N2;正确答案:7N2H4![]() 8NH3+2H2+3N2。
8NH3+2H2+3N2。
(5)该反应为放热反应,温度升高,平衡逆向移动,NO的转化率降低,在催化剂甲作用下,图中Y点处(210℃) NO的转化率应小于平衡时X点的转化率,而Y点反应而大,则一定不是该温度下的平衡转化率,A正确;在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是催化剂活性降低,B正确;300℃时,M点的NO平衡转化率高于Z点原因也可能是不同催化剂在相同温度的活性不同引起的,C错误;其他条件不变,增加NH3的浓度,正逆反应速率都增大,平衡向正反应方向移动,D错误;正确选项CD。
III. (6) 根据反应为Cr2O3 (s) +2NH3(g) ![]() 2CrN(s)+3H2O(g),在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,可能的原因是:提高NH3流量相当于使c(NH3)增大若反应未达到平衡,反应物浓度增大反应速率加快,一定时间内Cr2O3转化率提高,若反应达创平衡,反应物浓度增加且带走H2O,都使平衡正移,提高Cr2O3转化率;正确答案:提高NH3流量相当于使c(NH3)增大,若反应未达到平衡,反应物浓度增大反应速率加快,一定时间内Cr2O3转化率提高,若反应达创平衡,反应物浓度增加且带走H2O,都使平衡正移,提高Cr2O3转化率。
2CrN(s)+3H2O(g),在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,可能的原因是:提高NH3流量相当于使c(NH3)增大若反应未达到平衡,反应物浓度增大反应速率加快,一定时间内Cr2O3转化率提高,若反应达创平衡,反应物浓度增加且带走H2O,都使平衡正移,提高Cr2O3转化率;正确答案:提高NH3流量相当于使c(NH3)增大,若反应未达到平衡,反应物浓度增大反应速率加快,一定时间内Cr2O3转化率提高,若反应达创平衡,反应物浓度增加且带走H2O,都使平衡正移,提高Cr2O3转化率。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】【题目】氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用下图装置进行实验确定其化学式(固定装置略去)。
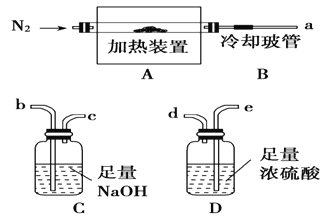
(1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式___________________________。
(2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为________(按气流方向,用接口字母表示),其中C的作用是________。装置连接后,首先要进行的操作的名称是________。
(3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是______________________、_________________等。
(4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=________。若取消冷却玻管B后进行实验,测定的x值将________(填“偏高”或“偏低”)。
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2y·(CO3)y·zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子能在强碱性溶液中大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Mg2+、Cl-B.Na+、Ba2+、HCO3-、NO3-
C.Na+、NO3-、CO32-、Cl-D.K+、H+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示.下列说法正确的是( ) 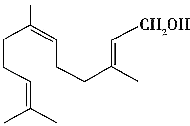
A.金合欢醇与乙醇是同系物
B.金合欢醇可发生加成反应,但不能发生取代反应
C.1 mol 金合欢醇能与3 mol H2 反应,也能与3 mol Br2反应
D.1 mol 金合欢醇与足量Na 反应生成0.5 mol 氢气,与足量NaHCO3溶液反应生成1molCO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中应注重食谱营养搭配的均衡性,下列午餐食谱中最有利于学生身体发育的是
A. 馒头、榨菜、黄瓜、香蕉
B. 面条、醋溜土豆丝、素炒白菜
C. 米饭、糖醋排骨、粉蒸肉、清蒸鲈鱼
D. 米饭、红烧鲫鱼、西红柿蛋汤、蒜蓉生菜、苹果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,一定量的Na2C03与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(![]() )与pH的关系如图所示。下列说法正确的是
)与pH的关系如图所示。下列说法正确的是

A. 曲线X表示的微粒为CO32-
B. pH=6.3时,![]() (CO32-)+
(CO32-)+![]() (HCO3-)+
(HCO3-)+![]() (H2CO3)=1.0
(H2CO3)=1.0
C. pH=7时,c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)=c(H+)
D. pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com