
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
N2(g)+2O2(g)![]() 2NO2(g) △H=+68 kJ/mol
2NO2(g) △H=+68 kJ/mol
则 2NO(g)+O2(g)![]() 2NO2(g) △H=__________ kJ/mol
2NO2(g) △H=__________ kJ/mol
(2)对于反应2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是__________
A. 整个反应的速率由第一步反应速率决定
B. 同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
C. 第二步反应速率慢,因而平衡转化率也低
D. 第二步反应的活化能比第一步反应的活化能高
(3)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H<0,图为平衡时NO的体积分数与温度、压强的关系:
2CO2(g)+N2(g) △H<0,图为平衡时NO的体积分数与温度、压强的关系:
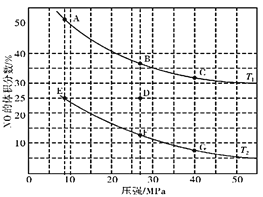
①温度:T1__________T2(填“>”、“<”或“=”)。
②若在D点对反应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的__________点(填字母)。
③某研究小组探究该反应中催化剂对脱氮率(即NO转化率)的影响。将相同量的NO和CO 以一定的流速分别通过催化剂a和b,相同时间内测定尾气,a结果如图中曲线I所示。已知:催化效率 b>a;b的活性温度约450℃。在图中画出b所对应的曲线(从300℃开始画) _______。
(4)在汽车的排气管上加装催化转化装置可减少NOx的排放。研究表明,NOx的脱除率除与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+X(A、B 均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:I . NO(g)+□→NO(a)
II . 2NO(a)→2N(a)+O2(g) III. 2N(a)→N2(g)+2□
IV. 2NO(a)→N2(g)+2O(a) V. 2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原 B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是________。
【答案】-112 BD > A  还原后催化剂中金属原子的个数不变,低价态金属离子越多,氧缺位增多,反应速率加快
还原后催化剂中金属原子的个数不变,低价态金属离子越多,氧缺位增多,反应速率加快
【解析】
(1)根据盖斯定律,将已知的两个热化学方程式相减,整理,可得待求反应的热化学方程式;
(2)A. 整个反应的速率由慢反应决定;
B. 根据①同一温度下,平衡时第一步反应的k1正/k1逆越大,化学平衡常数越大;
C. 反应速率低与转化率无因果关系;
D. 相同温度下,第一步反应快速达到平衡,第二步是慢反应,反应越快,说明反应的活化能越低;反应越慢,说明反应的活化能越高;
(3)①根据压强不变时,升高反应温度,化学平衡逆向移动,利用温度对NO的体积分数的影响确定T1与T2大小关系;
②对容器升高温度的同时扩大体积使体系的压强减小,则平衡逆向移动,NO体积分数增大;
③根据在一定温度范围内,升高温度,催化剂活性较大,超过其温度范围,催化剂活性降低,催化剂不能使平衡发生移动,不能改变物质的平衡转化率,催化效率高,反应速率快,先达到化学平衡状态;
(3)还原后催化剂中金属原子的个数不变,低价态金属离子越多,氧缺位增多,反应速率加快;根据盖斯定律分析可得。
(1)已知①N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g)![]() 2NO2(g) △H=+68 kJ/mol
2NO2(g) △H=+68 kJ/mol
盖斯定律计算②-①,整理可得2NO(g) +O2(g)![]() 2NO2(g) △H=-112 kJ/mol;
2NO2(g) △H=-112 kJ/mol;
(2) A.整个反应的速率由慢反应决定,A错误;
B. 根据①同一温度下,平衡时第一步反应的![]() 越大,化学平衡常数越大,则反应正向程度越大,B正确;
越大,化学平衡常数越大,则反应正向程度越大,B正确;
C. 反应速率低与转化率大小无关,因此不能根据反应速率慢判断反应达到平衡时物质的转化率小,C错误;
D. 相同温度下,第一步反应快速达到平衡,第二步是慢反应,说明第二步反应的活化能比第一步反应的活化能高,D正确;
故合理选项是BD;
(3)①该反应的正反应是气体体积减小的放热反应,在压强不变时,升高温度,化学平衡向吸热的逆反应方向移动,使NO的体积分数增大,根据图象可知:在温度为T1时体积分数大,可确定温度:T1>T2;
②该反应的正反应为放热反应,在相同压强时,温度升高,平衡逆向移动,NO体积分数增大,根据图象可知反应温度:B>D>F。在D点对反应容器升温的同时扩大体积,使体系的压强减小,则化学平衡逆向移动,最终导致NO的体积分数增大,所以重新达到平衡时,可能D点变为图中的A点;
③在一定温度范围内温度升高,催化剂活性增大,但达到平衡时NO脱除率降低,且催化剂b的催化效率 b>a,b的活性温度约450℃。在相同温度时,b比a先使NO达到最大脱氮率,所以催化剂b的曲线表示为 ;
;
(3)第一阶段用氢气还原B4+得到低价态的金属离子增多,还原后催化剂中金属原子的个数不变,价态降低,低价态的金属离子越多,氧缺位增多,反应速率加快,故第二阶段反应的速率越快。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是( )
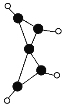
A.X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色
B.如图表示的为X的结构式
C.X和戊烷类似,都容易发生取代反应
D.充分燃烧等质量的X和甲烷,甲烷消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸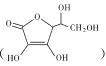 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A. ![]()
B. 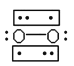
C. ![]()
D. 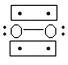
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )
①苯的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1mol苯最多与3molH2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
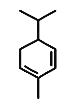
⑤CH2=CH2与CH2=CH-CH=CH2互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦所有卤代烃都能发生水解反应
A.①②⑤B.①④⑦C.③⑤⑥D.③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X由三种元素(其中一种是第四周期元素)组成,现进行如下实验:
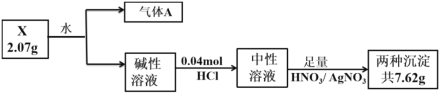
已知:气体A在标准状况下密度为0.714 g·L-1;碱性溶液焰色反应呈黄色。
(1)X中非金属元素的名称为__________,X的化学式__________。
(2)X与水反应的化学方程式为_________。
(3)化合物Y由X中金属元素和第四周期元素构成,设计实验证明Y的晶体类型__________。
(4)补充焰色反应的操作:取一根铂丝,________,蘸取待测液灼烧,观察火焰颜色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+ 和Cu2+的装置如右图。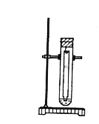
以下叙述错误的是
A.该方法为径向纸上层析法B.试样点晾干后才能补滴
C.试样点不能接触展开剂D.可喷KSCN溶液检验分离出来的Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com