
【题目】将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是 ( )。
A.原混合物中铜和铁各0.075 mol
B.稀硝酸的物质的量浓度为0.5 mol·L-1
C.第一次剩余4.8 g金属为铜和铁
D.再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO
【答案】A
【解析】
试题分析:A.整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、2(x+y)/3=2.24/22.4,联立方程,解得:x=0.075mol、y=0.075mol,A.由上述分析可知,原混合物中铜和铁各0.075mol,故A正确;B.根据方程式可知,n(HNO3)=4n(NO)=0.4mol,稀硝酸的物质的量浓度为0.4mol÷0.2L=2mol/L,故B错误;C.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,故第一次剩余金属4.8g为Cu的质量,故C错误;D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为![]() =0.025mol,其体积为0.025mol×22.4L/mol=0.56L,故D错误;故选A。
=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,故D错误;故选A。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
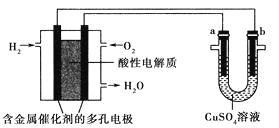
A. 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B. 电解精炼铜时,若转移1mol电子,a极质量减少32g
C. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )
A.任意位置寻找
B.稀有气体元素中寻找
C.金属和非金属的分界线处寻找
D.活泼金属和活泼非金属区中寻找
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关的判断或表示方法正确的是
A.一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH<-38.6 kJ·mol-1
2NH3(g) ΔH<-38.6 kJ·mol-1
B.中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验。
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:2CO2(g)===2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)I.甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X(一种钠盐)溶液鉴别它们,已知气体B的密度在同温同压下是氢气密度的22倍。试根据下图中的转化关系回答问题:
(1)下列物质的化学式分别为:甲____________、丙_____________、丁__________;
(2)戊的电子式为________________________;
(3)写出白色沉淀A与乙反应的离子方程式为__________________________。
II.已知:工业制备二甲醚的催化反应室中进行下列反应
CO(g)+2H2(g)![]() CH3OH(g)△H=-90.7kJ/mol①
CH3OH(g)△H=-90.7kJ/mol①
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ/mol③
CO2(g)+H2(g)△H=-41.2kJ/mol③
催化反应室中总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的△H= _____________。
CH3OCH3(g)+CO2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于新能源的是
①煤 ②火力发电 ③太阳能 ④生物质能 ⑤石油 ⑥氢能
A. ①②③ B. ③④⑥
C. ②③⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中ΔH1小于ΔH2的是
(1)S(s)+O2(g)===SO2(g),ΔH1
S(g)+O2(g)===SO2(g),ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l),ΔH1
CH4(g)+1.5O2(g)===CO(g)+2H2O(g),ΔH2
(3)4Al(s)+3O2(g)===2Al2O3(s),ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s),ΔH2
(4)放热反应CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
CO(g)+2H2(g)![]() CH3OH(l)ΔH2
CH3OH(l)ΔH2
A.只有(2) B.只有(2 ) (4)
C.只有(1) (2 ) (4) D.只有(2 ) (3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁、铝合金、铜合金三种合金具有广泛的用途,下列说法正确的是( )
A.碳钢与生铁的主要成分相同,所以性能相同
B.镁铝合金可用于制造飞机、汽车等部件
C.铜合金具有优良的导电、导热性能,但耐腐蚀能力较差
D.铝铁合金具有很高的熔点,能用于制造火箭外层材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y)的关系示意图正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com