
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |


 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| 组别 | c(一元酸) | c(NaOH)/mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | 0.1 | pH=10 |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol/L | 0.1 | pH=9 |
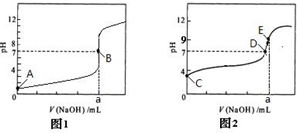
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
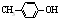 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )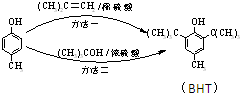
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与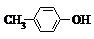 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴有酚酞的Na2CO3溶液 |
| B、溶有SO2的品红溶液 |
| C、滴有石蕊的AlCl3溶液 |
| D、滴有酚酞的饱和Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷和丁烷互为同系物,化学性质相似 |
| B、丙烷和丁烷的特征反应均为取代反应 |
| C、C3H8没有同分异构体,C4H10有两种同分异构体 |
| D、等质量的丙烷和丁烷完全燃烧时,后者耗氧量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )| A、导线上的电流方向为A→B |
| B、A中SO42-浓度有所减小 |
| C、盐桥中Cl-向A中移动 |
| D、B中铜片质量有所增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C、一小块钠投入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ |
| D、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com