
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |


科目:高中化学 来源: 题型:
| 化学键 | H-H | O=O | H-O |
| 键能kJ?mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
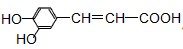
| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1mol咖啡酸可与4mol H2发生加成反应 |
| D、1mol咖啡酸最多能消耗3mol的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA |
| B、标准状况下,22.4L H2O所含有原子数为3NA |
| C、NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2:1 |
| D、1mol/L NaCl溶液含有2NA个氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
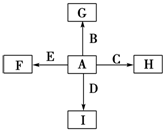
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com