
| 化学键 | H-H | O=O | H-O |
| 键能kJ?mol-1 | 436 | 496 | 463 |


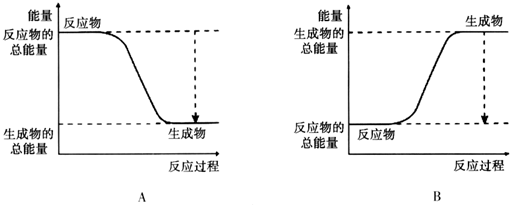
科目:高中化学 来源: 题型:
| A、Na+、NO3-、K+、Fe2+ |
| B、Fe2+、Na+、SO42-、K+ |
| C、K+、I-、NO3-、H+ |
| D、NH4+、NO3-、Na+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | c(一元酸) | c(NaOH)/mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | 0.1 | pH=10 |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol/L | 0.1 | pH=9 |
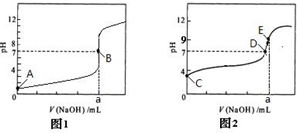
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
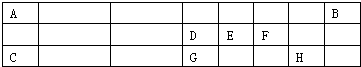
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | 0 | ||||||
| A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | B |
| D | E | F | I | ||||
| C | G | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
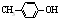 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )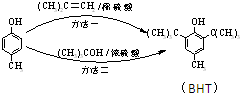
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与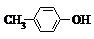 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com