
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下面判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、元素金属性:甲>丙 |
| C、氢氧化物碱性:丙<丁<戊 |
| D、丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
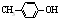 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )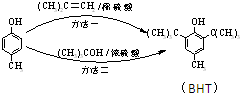
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与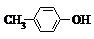 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷和丁烷互为同系物,化学性质相似 |
| B、丙烷和丁烷的特征反应均为取代反应 |
| C、C3H8没有同分异构体,C4H10有两种同分异构体 |
| D、等质量的丙烷和丁烷完全燃烧时,后者耗氧量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )| A、导线上的电流方向为A→B |
| B、A中SO42-浓度有所减小 |
| C、盐桥中Cl-向A中移动 |
| D、B中铜片质量有所增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A2-)+c(OH-)=c(H2A)+c(H+) |
| B、c(HA-)>c(A2-)>c(H2A) |
| C、c(HA-)>c(H+)>c(OH-) |
| D、c(HA-)>c(OH-)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:| C.(I-)/mol?L-1 | C.(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com