
| A、标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA |
| B、标准状况下,22.4L H2O所含有原子数为3NA |
| C、NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2:1 |
| D、1mol/L NaCl溶液含有2NA个氯离子 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
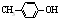 出发合成BHT的方法有如图两种.下列说法错误的是( )
出发合成BHT的方法有如图两种.下列说法错误的是( )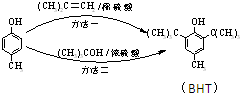
| A、两种方法的反应类型都是加成反应 |
| B、BHT在水中的溶解度小于苯酚 |
C、BHT与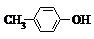 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 |
| D、从绿色化学角度分析方法一优于方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、气态氢化物的热稳定性:H2T>H2R |
| C、M与T形成的化合物能溶于氨水溶液 |
| D、相同条件下,单质与同浓度稀盐酸反应的速率:M>L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、NO3-、Cu2+ |
| B、Ba2+、Mg2+、Cl-、NO3- |
| C、H+、K+、OH-、NO3- |
| D、NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中被氧化与被还原的元素,其原子的物质的量之比为1:2 |
| B、NF3与NH3化学性质的不同是因F与H两元素非金属性的差异引起 |
| C、NF3一旦泄漏,可用NaOH溶液喷淋,只有NaF、NaNO3和H2O产生 |
| D、若反应中转移0.2mol电子,则生成的NO气体体积约为4.48L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C、一小块钠投入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ |
| D、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:| C.(I-)/mol?L-1 | C.(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:
 填写下列空白:
填写下列空白: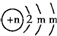 ,请回答下列问题:
,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com