
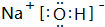 ,故答案为:
,故答案为: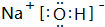 ;
;
| ||
| ||
| 1mol×2g/mol |
| 1g |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、还原产物为NH4+ |
| B、氧化剂与还原剂的物质的量之比为1:8 |
| C、若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D、若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、ClO-、Na+、SO42- |
| B、在含较多Al3+的溶液中:K+、Cl-、HCO3- |
| C、一小块钠投入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ |
| D、铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在 800℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,CO和H2O的物质的量浓度变化如图所示,则:| C.(I-)/mol?L-1 | C.(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:
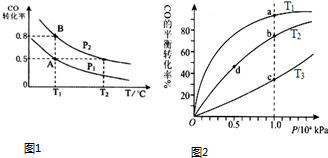
查看答案和解析>>
科目:高中化学 来源: 题型:
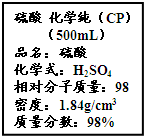 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 填写下列空白:
填写下列空白: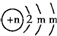 ,请回答下列问题:
,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O5 |
| △ |
| c2-c1 |
| t2-t1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com