
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-)=c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D.若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
科目:高中化学 来源: 题型:单选题
某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
| A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液; |
| B.用0.10 mol/L的HCl溶液润洗酸式滴定管; |
| C.把滴定管用蒸馏水洗净; |
| D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面; |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向NaOH(aq)滴入HAc(aq)的过程中,溶液中离子浓度的大小可能正确的是
| A.c(OH-) = c(Na+) > c(Ac-) > c(H+) | B.c(Na+) > c(OH-) = c(Ac-) > c(H+) |
| C.c(Na+) > c(Ac-) > c(OH-) > c(H+) | D.c(H+) > c(Ac-) > c(Na+) > c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为 |
B.Ki2对应的电离过程是HCO3— + H2O 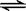 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| B.浓度均为0.1mol·L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| C.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比为1:2 |
| D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关溶液的说法正确的是
| A.向10mLpH=3的酣酸溶液中加入10mLpH=l1的NaOH溶液,混合液的pH=7 |
| B.实验测定NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>HCO3 |
| C.NH4CI溶液加水稀释过程中c(H+)+c(NH3·H2O)=c(OH一) |
| D.向AgI沉淀中加人饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com