
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:KSp(CaCO3)=4.96×10-9;KSp(MgCO3)=6.82×10-6;KSp[Ca(OH)2]=4.68×10-6;KSp[Mg(OH)2]="5.61×10" -12。
下列说法不正确的是
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+和Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2 |
C
解析试题分析:步骤①,从题给的条件,可知n(NaOH)=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-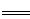 CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。
CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,故A正确;步骤①中,由于CO32-只有0.001mol,反应生成CaCO3所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010mol·L-1,所以滤液M中同时存在着Ca2+和Mg2+,故B正确;步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol·L-1.则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成,Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成,又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,故C错误;步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-=Mg(OH)2↓,生成0.05 molMg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀,故D正确。
考点:考查考查了Ksp的应用和计算,离子反应等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
| A.Al(OH)3的电离方程式为:Al(OH)3=Al3++3OH- |
| B.a点溶液中有: c(H+)+c(Al3+)=c(OH-) +3c(Cl-) |
| C.曲线X表示盐酸稀释过程的pH变化 |
| D.b、c两溶液c(OH-)及c(Cl-)均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有浓度均为0.1 mol/L的五种电解质溶液:A.Na2CO3、B.NaHCO3、C.NaAlO2、D.CH3COONa、E.NaOH。
(1)这五种溶液中水的电离程度最大的是 (填编号)。
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 (填编号)。
(3)将上述A、B、C、D四种溶液两两混合时,有一对溶液相互间能够发生反应,写出该反应的离子方程式: 。
(4)将CO2通入A溶液中恰好呈中性,溶液中2c(CO32-)+c(HCO3-)= mol/L (设反应前后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A.若a=b,则c(NH4+)=c(Cl-) |
| B.若a>b,则c(NH4+)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC )+c(H+)>c(C )+c(H+)>c(C ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S )>c(N )>c(N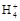 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )
| A.①点溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl-)>c(CH3COO-) |
| D.③点后因离子数目减少使溶液电导率略降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中微粒浓度关系不正确的是( )
| A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) |
| B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com