
【题目】某NaAlO2、Na2CO3的混合溶液中逐滴加入 1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)则下列说法正确的是
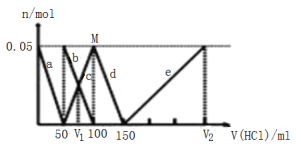
A.V1:V2=1:4
B.M点时生成的CO2为0.05mol
C.原混合溶液中的CO32-与AlO2-的物质的量之比为1:3
D.a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O
【答案】A
【解析】
Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸后,首先发生反应:![]() ,a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
,a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
AlO2-反应完毕,发生反应:![]() ,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
CO32-反应完毕,发生反应![]() ,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
发生反应![]() ,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,进而求出消耗盐酸的体积。
,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,进而求出消耗盐酸的体积。
Na2CO3、NaAlO2的混合溶液中逐滴加入1molL-1的盐酸后,首先发生反应:![]() ,a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
,a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
AlO2-反应完毕,发生反应:![]() ,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
CO32-反应完毕,发生反应![]() ,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
发生反应![]() ,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为:
,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为:![]() 。
。
A. 原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应![]() 可知,需要盐酸为0.025mol,盐酸的体积为25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故A正确;
可知,需要盐酸为0.025mol,盐酸的体积为25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故A正确;
B. 根据述分析可知,M点时溶液中CO32-完全转化为HCO3-,没有CO2生成,故B错误;
C. 由上述分析可知,原混合溶液中的CO32-与AlO2-的物质的量之比为:0.05mol:0.05mol=1:1span>,故C错误;
D. 由上述分析可知,a曲线表示的离子方程式为:![]() ,故D错误;
,故D错误;
故答案选:A。


科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
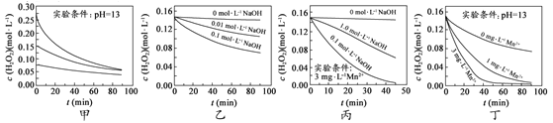
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法正确的是
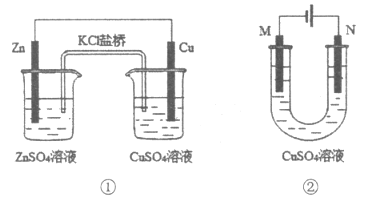
A.装置①中Cu为正极,电极上大量气泡产生
B.装置①中e-的迁移方向是:Zn→导线→Cu→盐桥→Zn
C.若装置②用于铁棒镀铜,则N极为铜棒
D.若装置②用于电解精炼铜,则电解前后溶液中的Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置能达到目的的是( )
A | B | C | D |
|
|
|
|
混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物N具有镇痛、消炎等药理作用,其合成路线如下:

(1)A的系统命名为____________,E中官能团的名称为____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为____________。
(3)C→D的化学方程式为________________________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应:且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为____________。
(5)F与G的关系为(填序号)____________。
a.碳链异构 b.官能团异构 c.顺反异构 d.位置异构
(6)M的结构简式为____________。
(7)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。

该路线中试剂与条件1为____________,X的结构简式为____________;
试剂与条件2为____________,Y的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2MO4在水中电离分以下两步:H2MO4H++HMO4-,HMO4-H++MO42-。常温下向20 mL0.1mol/L NaHMO4溶液中滴入cmol/LNaOH溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
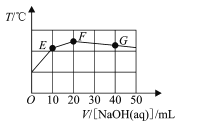
A.该氢氧化钠溶液pH=12
B.图像中F点对应的溶液中c(OH-)>c(HMO4-)
C.滴入NaOH溶液过程中水的电离程度一直增大
D.图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种重要的化工原料,以FeO·Cr2O3为原料制备K2Cr2O7的流程如下:

已知:2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
回答下列问题:
(1)写出滤渣的一种用途:___________________。
(2)“调节pH”可实现CrO42-和Cr2O72-在溶液中相互转化。室温下,若初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示:

①由图可知,溶液酸性增大,CrO42-的平衡转化率________(填“增大”“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为_________。
(3)流程中的“转化”过程中发生的反应属于_________(填基本反应类型)。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,不溶于乙醇,潮湿的CuCl在空气中被氧化为Cu2(OH)3Cl。
(1)一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:

①“溶解”步骤发生反应的离子方程式为_________________________________;
②潮湿的CuCl在空气中被氧化的化学反应方程式为_________________________________;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为___________以上。
(2)次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的化学方程式:_____________;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:___________;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com