
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是
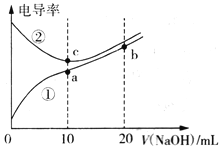
A. 曲线①代表滴定盐酸的曲线
B. a点溶液中: c(OH-)+c(CH3COO-)-c(H+) =0.1 mol/L
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
【答案】D
【解析】醋酸为弱酸,等浓度时离子浓度比盐酸小,则导电性较弱,由此可知①为醋酸的变化曲线,②为盐酸的变化曲线,加入氢氧化钠,醋酸溶液离子浓度逐渐增大,导电性逐渐增强,盐酸发生中和反应,离子浓度减小,由图象可知加入氢氧化钠10mL时完全反应,对于离子浓度大小比较可以利用物料守恒和电荷守恒考虑解决。
由分析可知,曲线①代表滴定CH3COOH溶液的曲线,曲线②代表滴定HCl溶液的曲线,A选项错误;a点氢氧化钠与CH3COOH溶液恰好反应生成CH3COONa,a点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,B选项错误;酸或碱抑制水的电离,含有弱酸根离子的盐促进水的电离,c点溶质为NaCl,a点溶质为醋酸钠,醋酸根离子促进水的电离,b点为等物质的量浓度的醋酸钠和NaOH的混合物,NaOH会抑制水的电离,所以在相同温度下,水的电离程度大小关系: b<c<a,C选项错误;b点为等物质的量浓度的醋酸钠和NaOH的混合物,根据电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)和物料守恒:2c(CH3COO-)+2c(CH3COOH)= c(Na+)得:c(OH-)= c(H+)+c(CH3COO-)+2c(CH3COOH),所以有c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH),D选项正确;正确答案:D。


科目:高中化学 来源: 题型:
【题目】Ⅰ.NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、
⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:
______________________________
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_______________________________。
(5)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
![]()
(1)写出A、B、C三元素名称________、________、________。
(2)C在元素周期表中的位置是____________________。
(3)B的原子结构示意图为________________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径A________C,写出A的气态氢化物与A的最高价氧化物对应水化物反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 不同的离子化合物所含的化学键相同
B. 离子键是阴阳离子间的静电吸引
C. 同素异形体之间的相互转化是化学变化,
D. 非金属元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
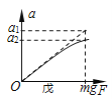
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是:
A. Fe与稀硫酸反应制取H2时,改用浓硫酸
B. Na与水反应时增大水的用量
C. 在K2SO4与BaCl2两溶液反应时,增大压强
D. 密闭容器中进行的反应:C+O2![]() CO2,增大压强
CO2,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)试管Ⅰ和Ⅱ中分别加入3 mL稀盐酸(均足量),再将装0.3 g NaHCO 3和0.3 g Na2CO3粉末的小气球分别套在试管Ⅰ和Ⅱ的管口。将气球内的 NaHCO3和Na2CO3同时倒入试管中,请回答下列问题:

①试管Ⅰ中发生反应的离子方程式为________。
②加入固体后,试管_______(填 “Ⅰ”或“Ⅱ”)上的气球膨胀较快。
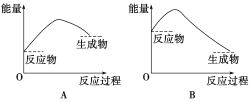
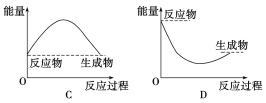
(2)为研究Na2CO3、NaHCO3与盐酸的反应是吸热反应还是放热反应,某同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 35 mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5 g NaHCO3 | 20.0 | 18.5 |
② | 水 | 3.2 g Na2CO3 | 20.0 | 24.3 |
③ | 盐酸 | 2.5 g NaHCO3 | 20.0 | 16.2 |
④ | 盐酸 | 3.2 g Na2CO3 | 20.0 | 25.1 |
①设计1、2组实验的目的是:_______。
②通过上述实验可得出:NaHCO3溶液和盐酸的反应是_____反应,对应的图像为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol·L-1 KSCN溶液中:Fe3+、NH4+ 、Br-、SO42 -
B. ![]() =106的溶液中:NH4+ 、K+、AlO2- 、NO3-
=106的溶液中:NH4+ 、K+、AlO2- 、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42 -、Cl-
D. 0.1 mol·L-1 Ca(NO3)2溶液中:Na+、NH4+ 、CO32 -、CH3COO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com