
【题目】A、B、C、D四种元素原子序数依次增大;A元素最内层与最外层的电子数相同;B元素L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层,K层和L层电子数之和等于M层与N层电子数之和。写出:
(1)元素符号:A_____________B____________C___________D__________________
(2)A的原子结构示意图____________,B离子的电子式____________,C的离子结构示意图________________,D原子的电子式____________________。
【答案】Be F Al Ca 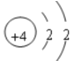
![]()

![]() 或·Ca·
或·Ca·
【解析】
A、B、C、D四种元素原子序数依次增大;B元素L层比K层电子数多5个,L层电子数为7,故B为F元素;A元素最内层与最外层的电子数相同,最外层电子数为2,原子序数小于氮,故A为Be元素;C元素的+3价阳离子和氖原子具有相同的电子数,则C为Al元素;D元素的原子核外有4个电子层,K层和L层电子数之和等于M层与N层电子数之和,则M、N电子数之和为10,说明原子核外各层电子数分别为2、8、8、2,故D为Ca元素,据此分析解答。
(1)A、B、C、D四种元素原子序数依次增大;B元素L层比K层电子数多5个,L层电子数为7,故B为F元素;A元素最内层与最外层的电子数相同,最外层电子数为2,原子序数小于氮,故A为Be;C元素的+3价阳离子和氖原子具有相同的电子数,则C为Al;D元素的原子核外有4个电子层,K层和L层电子数之和等于M层与N层电子数之和,则M、N电子数之和为10,说明原子核外各层电子数分别为2、8、8、2,故D为Ca元素,故答案为:Be;F;Al;Ca;
(2)A为Be,原子结构示意图为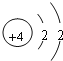 ,B为F元素,离子的电子式为
,B为F元素,离子的电子式为![]() ,C为Al元素,离子为Al3+,离子结构示意图为
,C为Al元素,离子为Al3+,离子结构示意图为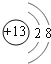 ,D为Ca元素,钙原子的电子式为
,D为Ca元素,钙原子的电子式为![]() 或·Ca·,故答案为:
或·Ca·,故答案为: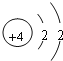 ;
;![]() ;
; ;
;![]() 或·Ca·。
或·Ca·。


科目:高中化学 来源: 题型:
【题目】实验实验室配制500mL 0.1molL-1的碳酸钠溶液,请回答下列问题.
(1)应用托盘天平称取Na2CO310H2O晶体__________g.
(2)配置碳酸钠溶液时,需要的主要玻璃仪器除烧杯和胶头滴管以外还需要_________、____________.
(3)配置过程中,若遇到以下操作可能造成实验结果偏大,偏小还是不影响?
①容量瓶中原来有少量蒸馏水_____
②定容时,俯视液面_____
③有少量氢氧化钠溶液残留在烧杯中_____
④盖好瓶塞反复摇匀,发现液面低于标线,再加蒸馏水使液面达到刻度处_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钡是一种比碳酸钡更难溶的物质。常温下-lgc(Ba2+)随-lgc(CO32-)或-lgc(SO42-)的变化趋势如图,下列说法正确的是

A. 趋势线A表示硫酸钡
B. 常温下,Ksp(BaCO3)=1×10-11
C. 将碳酸钡和硫酸钡固体置于水中,此时溶液中的![]() =10
=10
D. 在硫酸钡悬浊液中,若要使0.1mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到化学平衡的反应:2SO2(g)+O2(g)2SO3(g),缩小体系体积,下列叙述中正确的是
A.活化分子的百分数增大,反应速率增大
B.单位体积内活化分子数增多,反应速率增大
C.正反应速率增大,逆反应速率减小,平衡正向移动
D.逆反应速率增大,正反应速率减小,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯盐可导致混凝土中的钢筋腐蚀。为防止混凝土中的钢筋腐蚀,可在混凝土表面敷置一定电解质溶液并将惰性金属导电网浸泡其中,惰性金属导电网与钢筋分别连接外部直流电源从而除去Cl-,装置如图,下列说法错误的是

A. 钢筋接电源的正极
B. 金属导电网上发生的电极反应为2Cl—2e-=Cl2↑
C. 混凝土中的钙离子向钢筋方向移动
D. 电解一段时间后钢筋附近溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设C(s)+CO2(g)===2CO(g) ΔH>0,反应速率为v1;N2(g)+3H2(g)===2NH3(g) ΔH<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A. 同时增大B. 同时减小C. v1增大,v2减D. v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:

mA(g)+nB(g)![]() pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
pD(g)+qE(s) H<0(m、n、p、q为最简比例的整数)。
(1)根据图1所示,反应开始至达到平衡时,用D表示该反应速率为____________ mol/(L·min);方程式中m:n:p:q =________________
(2)该反应的化学平衡常数K为_________________(保留至一位小数);
(3)下列措施能增大B的转化率的是 ( )
A.升高温度 B.保持体积不变通入1molB
C.保持体积不变移出部分物质D(g) D.将容器的容积增大为原来的2倍
E. 保持体积不变通入1mol A
(4)能判断该反应已经达到化学平衡状态的是( )
A.恒容恒温时容器中气体压强保持不变
B.混合气体中D浓度不变
C.v(A)正 = v(A)逆
D.恒容时容器中气体密度不变
(5)反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出第7 min至第15 min(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度且平衡时D物质的量变化了0.4 mol (用虚线)
②若将容器的容积压缩为原来一半(用实线)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.已知该反应的原子利用率为100%,则A为CO2
B.CH3OH和甘油互为同系物
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com