
【题目】在日常生活中会接触到许多物质,下列物质中属于碱性氧化物的是
A. 硫酸铵B. 二氧化碳C. 生石灰D. 乙醇
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业的基础,下图是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水,通电几分 钟后,将湿润的淀粉碘化钾试纸放在A电极一端的管口,试纸变蓝色,请回答:
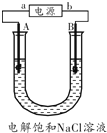
(1)b端为电源的_______极;请用化学方程式解释使湿润的淀粉淀化钾试纸变蓝的原因_____________
(2)写出B极的电极反应式_______
(3)若在U形管的两端分别滴加无色酚酞溶液,则一段时间后_____极(填“A”或“B”)呈红色
(4)请写出电解饱和食盐水的化学方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国、日本、加拿大等国统计,每年因金属腐蚀造成损失占国民经济总值1%,是地震、风灾、火灾损失的总和。下图是某研究小组的金属腐蚀探究实验装置图。

(1)酸雨浸泡过的铁钉置于试管中(如图),一段时间后,如果U形管中红墨水液面左高右低,则铁钉发生了(_______)(填“A”或“B”),如果U形管内液面左低右高,则铁钉发生了(_______)(填“A”或“B”)。
A.析氢腐蚀 B. 吸氧腐蚀
研究小组发现开始一段时间,U形管内液面左低右高,再过一段时间右边液面不仅没有继续升高,反而有回落的趋势(装置气密性良好),造成这一现象的原因是___________。
(2)若将铁钉换成含杂质炭的锌块,并在试管中加入少许氯化钠溶液,一段时间后,U形管内液面出现了左高右低的现象。试写出电极反应式,
负极____________________,
正极______________________________。
(3)若将锌块换成铜块(含杂质炭),并加入少许0.1mol/L的硫酸溶液,_______(填“能”或“不能”)发生析氢腐蚀;但一段时间后铜块明显发生了腐蚀,试写出其电极反应式:
负极_________________________,
正极________________________。
美国的“自由女神”是铜铸艺雕,表面因生铜绿而被腐蚀,写出空气中铜表面生成铜绿(Cu2(OH)2CO3)的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子序数依次增大;A元素最内层与最外层的电子数相同;B元素L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层,K层和L层电子数之和等于M层与N层电子数之和。写出:
(1)元素符号:A_____________B____________C___________D__________________
(2)A的原子结构示意图____________,B离子的电子式____________,C的离子结构示意图________________,D原子的电子式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缩醛是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。G可以由如图途径合成:

已知:I.A的分子式为C7H8,属于芳香烃;D的产量可以用来衡量一个国家石油化工发展水平;
Ⅱ.缩醛化反应原理:

Ⅲ.同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)F的名称为______________________。
(2)写出由A生成B的化学方程式:______________________。
(3)反应①的条件为___________;反应②的反应类型为___________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉效率高、污染物少的优点,维生素C的结构简式为 。则维生素C分子中含氧官能团的名称为___________、___________。
。则维生素C分子中含氧官能团的名称为___________、___________。
(5)缩醛G的结构简式为___________。同时满足下列条件的G的同分异构体有___________种(不考虑立体异构);其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为______________________。
①苯环上只有两个取代基
②既能发生银镜反应,又能与FeCl3溶液发生显色反应
(6)D的一种含4个碳原子的无支链同系物H,所有碳原子一定在同一平面上。H作为原料可用于制取目前产量居第二位的顺丁橡胶。试写出该合成路线(其他试剂任选):______________________ ![]() 顺丁橡胶。
顺丁橡胶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1mol·L-1的醋酸溶液至0.01mol·L-1,随着溶液的稀释,下列各项中始终保持增大趋势的是( )
A. B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g)![]() C(g)+D(g) △H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的4/5,下列叙述正确的是
C(g)+D(g) △H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的4/5,下列叙述正确的是
A. 从开始到平衡,A的反应速率为0.08mol·L![]() ·min
·min![]()
B. 随着反应的进行,混合气体的密度逐渐减小
C. 该温度下,反应的平衡常数K=20/3
D. 达到平衡时,B的转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺肿大,因此补充人体所需的元素时也要适可而止。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:________。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是________。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上不能用电解熔融氯化铝的方法获取铝单质,这是因为________________________________________。
(4)F与I是同一主族的元素,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(5)I2晶体的晶胞结构如图所示,该晶胞中含有________个I2分子,设该晶胞的晶胞参数为acm,则I2的密度是________________g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com