
【题目】硫酸钡是一种比碳酸钡更难溶的物质。常温下-lgc(Ba2+)随-lgc(CO32-)或-lgc(SO42-)的变化趋势如图,下列说法正确的是

A. 趋势线A表示硫酸钡
B. 常温下,Ksp(BaCO3)=1×10-11
C. 将碳酸钡和硫酸钡固体置于水中,此时溶液中的![]() =10
=10
D. 在硫酸钡悬浊液中,若要使0.1mol的硫酸钡完全转化成碳酸钡,则需要加入碳酸钠的物质的量至少为0.1mol
科目:高中化学 来源: 题型:
【题目】已知:AG=lgc(H+)/c(OH-),室温下用0.01mol·L1 NH3·H2O溶液滴定20.00mL 0.01mol·L1某一元酸HA,可得下图所示的结果,下列说法中错误的是

A. 该滴定实验最好选用甲基橙作指示剂
B. 整个过程中,C点时水的电离程度最大
C. 若x3=30,则有:3c(OH)=c(NH4+)+3c(H+)-2c(NH3·H2O)
D. A→C的过程中,可存在:c(A)>c(H+)>c(NH)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业的基础,下图是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水,通电几分 钟后,将湿润的淀粉碘化钾试纸放在A电极一端的管口,试纸变蓝色,请回答:
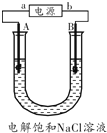
(1)b端为电源的_______极;请用化学方程式解释使湿润的淀粉淀化钾试纸变蓝的原因_____________
(2)写出B极的电极反应式_______
(3)若在U形管的两端分别滴加无色酚酞溶液,则一段时间后_____极(填“A”或“B”)呈红色
(4)请写出电解饱和食盐水的化学方程式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,该电池能长时间保持稳定的放电电压,放电时的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH,下列判断不正确的是
A. 放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 充电时,阴极pH增大
C. 充电时,阳极反应为Fe(OH)3+5OH-―3e-===FeO![]() +4H2O
+4H2O
D. 放电时,每转移6mol电子,则有1 mol K2FeO4被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种元素A、B、C、D,其中B2-与C+核外电子排布与Ne相同,B原子与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D的元素符号分别为________、_______、________、________。
(2)B2-的电子式为______,C+离子的电子式为______,D原子的结构示意图为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国、日本、加拿大等国统计,每年因金属腐蚀造成损失占国民经济总值1%,是地震、风灾、火灾损失的总和。下图是某研究小组的金属腐蚀探究实验装置图。

(1)酸雨浸泡过的铁钉置于试管中(如图),一段时间后,如果U形管中红墨水液面左高右低,则铁钉发生了(_______)(填“A”或“B”),如果U形管内液面左低右高,则铁钉发生了(_______)(填“A”或“B”)。
A.析氢腐蚀 B. 吸氧腐蚀
研究小组发现开始一段时间,U形管内液面左低右高,再过一段时间右边液面不仅没有继续升高,反而有回落的趋势(装置气密性良好),造成这一现象的原因是___________。
(2)若将铁钉换成含杂质炭的锌块,并在试管中加入少许氯化钠溶液,一段时间后,U形管内液面出现了左高右低的现象。试写出电极反应式,
负极____________________,
正极______________________________。
(3)若将锌块换成铜块(含杂质炭),并加入少许0.1mol/L的硫酸溶液,_______(填“能”或“不能”)发生析氢腐蚀;但一段时间后铜块明显发生了腐蚀,试写出其电极反应式:
负极_________________________,
正极________________________。
美国的“自由女神”是铜铸艺雕,表面因生铜绿而被腐蚀,写出空气中铜表面生成铜绿(Cu2(OH)2CO3)的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子序数依次增大;A元素最内层与最外层的电子数相同;B元素L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层,K层和L层电子数之和等于M层与N层电子数之和。写出:
(1)元素符号:A_____________B____________C___________D__________________
(2)A的原子结构示意图____________,B离子的电子式____________,C的离子结构示意图________________,D原子的电子式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g)![]() C(g)+D(g) △H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的4/5,下列叙述正确的是
C(g)+D(g) △H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的4/5,下列叙述正确的是
A. 从开始到平衡,A的反应速率为0.08mol·L![]() ·min
·min![]()
B. 随着反应的进行,混合气体的密度逐渐减小
C. 该温度下,反应的平衡常数K=20/3
D. 达到平衡时,B的转化率为20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com