
【题目】氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。
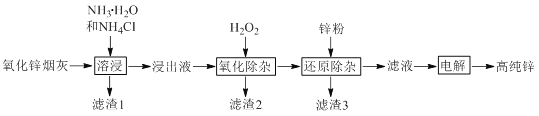
已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________。
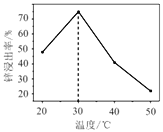
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________。
(4)“滤渣3”除锌外,主要成分为___________________。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________(写名称)。电解后的电解液经补充_________(写一种物质的化学式)后可返回至__________________(填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________。
【答案】第四周期ⅡB 低于30℃,溶浸反应速率随温度升高而增大,超过30℃,氨气逸出导致溶浸反应速率下降 2AsCl52+2H2O2+6NH3H2O=As2O5(胶体)+10Cl+6NH4++5H2O Cu、Cd 氮气 NH3或NH3H2O 溶浸 Zn(OH)1.6Cl0.4
【解析】
由流程可知,氧化锌烟灰加入氨水、氯化铵进行溶浸,溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在,加入过氧化氢,AsCl52-转化为As2O5胶体吸附聚沉除去,过滤后加入锌粉还原,可除去Cu、Cd等,滤液主要含有Zn(NH3)42+,电解可生成高纯度锌,以此解答该题。
(1)Zn的原子序数为30,其在元素周期表中的位置为第四周期ⅡB,
故答案为:第四周期ⅡB;
(2)根据温度与锌浸出率的图可知,30℃左右时浸出率最高,如低于30℃,溶浸反应速率随温度升高而增大,超过30℃,氨气逸出导致溶浸反应速率下降,
故答案为:低于30℃,溶浸反应速率随温度升高而增大,超过30℃,氨气逸出导致溶浸反应速率下降;
(3)“氧化除杂”中,AsCl52转化为As2O5胶体吸附聚沉除去,反应的离子方程式为2AsCl52+2H2O2+6NH3H2O=As2O5(胶体)+10Cl+6NH4++5H2O,
故答案为:2AsCl52+2H2O2+6NH3H2O=As2O5(胶体)+10Cl+6NH4++5H2O;
(4)锌可置换出Cu、Cd,“滤渣3”的主要成分为Cu、Cd,
故答案为:Cu、Cd;
(5)“电解”时Zn(NH3) 42+在阴极放电,发生还原反应生成锌,电极反应式为Zn(NH3) 42++2e=Zn+4NH3,阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是氮气,则电解后的电解液经补充氨气或氨水后可返回“溶浸”工序继续使用,
故答案为:氮气;NH3或NH3H2O;溶浸;
(6)“一次水解”时,产物为Zn(OH)xCly,取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全),则ZnO的物质的量为n(ZnO)=![]() =0.1mol,根据Zn元素守恒,则一次水解产物的物质的量也为0.1mol,则Zn(OH)xCly的摩尔质量为
=0.1mol,根据Zn元素守恒,则一次水解产物的物质的量也为0.1mol,则Zn(OH)xCly的摩尔质量为![]() =106.4g/mol,根据整体呈电中性,则有2=x+y,根据整体摩尔质量为106.4g/mol,则有65+17x+35.5y=106.4,联立x+y=2,65+17x+35.4y=106.4,解得x=1.6、y=0.4,所以一次水解产物的化学式为:Zn(OH)1.6Cl0.4,
=106.4g/mol,根据整体呈电中性,则有2=x+y,根据整体摩尔质量为106.4g/mol,则有65+17x+35.5y=106.4,联立x+y=2,65+17x+35.4y=106.4,解得x=1.6、y=0.4,所以一次水解产物的化学式为:Zn(OH)1.6Cl0.4,
故答案为:Zn(OH)1.6Cl0.4。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.10mol/L的NaA溶被中,不断通入HCl气体(忽略溶液体积变化),得到c(A-)和c(HA)与pH的变化关系如下,则下列说法正确的是
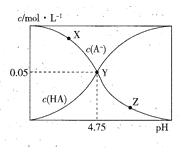
A. 水的电离程度:X<Z
B. 溶液的pH比较:X<Y<Z
C. Y点时:c(Na+)=2c(A-)>c(H+)>c(OH-)
D. 常温下、HA的Ka=104.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第____周期___族
(2)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的离子方程式是________________。
(3)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O ii: ……
① 写出ii的化学方程式:_________________________。
② 请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入__________溶液,溶液无颜色变化,再加入少量PbO2,溶液变为________色。
b.向a得到的溶液中加入___________________,溶液恢复原来的颜色。
(4)过程II中过滤操作所需要的玻璃仪器有__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
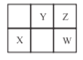
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生1:1加成的产物有两种:
①CH2Cl—CHCl—CH=CH2(1,2—加成) ②CH2Cl—CH=CH—CH2Cl (1,4—加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的1:1加成产物有几种(不考虑顺反异构和镜像异构( )
A. 6种B. 10种C. 12种D. 14种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应![]() ,
,![]() 为金属
为金属![]() ,下列推断中不正确的是
,下列推断中不正确的是![]()
![]()
A.BrCl同![]() 、
、![]() 具有相似的化学性质
具有相似的化学性质
B.常温下,BrCl可与NaOH反应生成NaCl和NaBrO
C.BrCl跟水的反应是氧化还原反应
D.BrCl的氧化性强于![]() ,弱于
,弱于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰![]() ,硫氰
,硫氰![]() 等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:
等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为:![]() ,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是( )
A.![]() 浓
浓![]()
![]()
![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com