
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
 HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。科目:高中化学 来源: 题型:填空题
如图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白。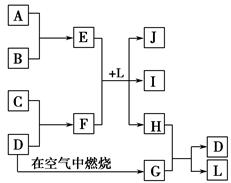
(1)框图中所列物质中属于非电解质的物质的化学式是 。
(2)用电子式表示出H的形成过程 。
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为 。
(4)F的水溶液中各离子浓度由大到小的顺序为 。
(5)F的水溶液显碱性的原因: (用离子方程式表示)。
(6)E与F在L中反应的离子方程式为 。
(7)H和G之间反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一同学分析硫元素的化合价有-2、0、+4、+6,而硫单质处于中间价态,所以硫应该既有氧化性,又有还原性。该同学欲探究硫的还原性,下面是该同学的实验探究过程,请解答其中的问题。
(1)该同学应该选择________(填“氧化剂”或“还原剂”)进行实验探究。
(2)该同学用红热的玻璃棒引燃了石棉网上的硫粉,硫粉开始燃烧,反应的化学方程式为________________________________________________
(3)该同学欲验证硫燃烧产物的性质,请你帮助他选择合适的试剂,并说明原因。
| A.新制的氯水 | B.品红溶液 | C.滴有酚酞的NaOH稀溶液 | D.H2S气体 |
| 性质 | 试剂 | 化学方程式 |
| 漂白性 | | |
| 氧化性 | | |
| 还原性 | | |
| 酸性氧化物 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一些常见化学反应可用下式表示 A + B → C+D+H2O 其中A为单质 (必要时可加热),请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,则A与B溶液反应的离子方程式为: 。
(2)若C、D均为气体且有一种为红棕色,则B是 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B反应的化学方程式为: 。
如何稀释B的浓溶液 。
(4) 若A为紫红色的固体,D为无色无味的气体,则A与B溶液反应的离子方程式为: 。若产生标准状况下4.48L的D气体,则被还原的B的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| | 注意事项 | 理由 |
| ① | | |
| ② | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅酸钠是一种重要的无机功能材料,某研究性学习小组设计的利用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的流程如下: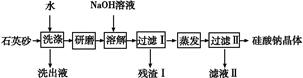
(1)石英砂加水洗涤的目的是 。
研磨后加入NaOH溶液溶解的离子方程式是 。
(2)实验室进行蒸发操作要用到的仪器有铁架台(含铁圈)、 和 。
(3)残渣Ⅰ的成分是 (填化学式)。将残渣Ⅰ溶于盐酸,再加入NaOH溶液得到沉淀,将该沉淀加入到NaClO和NaOH混合溶液中可制得一种优质净水剂,完成反应的离子方程式: + ClO-+ OH- + Cl-+ H2O
+ Cl-+ H2O
(4)按上述流程制得的硅酸钠晶体可表示为Na2O·nSiO2,若石英砂的质量为10.0 g,其中含SiO2的质量分数为90%,最终得到硅酸钠晶体15.2 g,则n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是_______________________。
(2)易与C发生化学反应的酸是______ (填名称),反应的化学方程式是_______。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学方程式:______________________________________,___________________________________________________________________。
②要将NaOH高温熔化,下列坩埚中不可选用的是_________________________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因 ;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释: 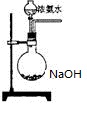
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com