
【题目】《本草图经》有“白矾多人药用”。白矾[KAl(SO4)2·12H2O]又称明矾.钾铝矾、钾明矾等,是一种重要的化学试剂。下列说法正确的是( )
A.含白矾的药物不宜与胃药奧美拉唑碳酸氢钠胶囊同时服用
B.0.1molL-1白矾溶液完全水解生成Al(OH)3胶粒数小于6.02×1022
C.向含0.1mol白矾的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部转化为BaSO4和Al(OH)3沉淀,则此时生成沉淀的质量最大
D.室温下,0.1molL-1白矾溶液中水电离出c(H+)小于10-7mol·L-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是

A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若②存在于皮下和内脏器官周围等部位,则②是脂肪
C. ③一定是核酸或是组成核酸的单体核苷酸
D. 若④是参与构成植物细胞壁的一种多糖,则④最可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)ΔH=__kJ/mol。
CH3OH(g)+H2O(l)ΔH=__kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。
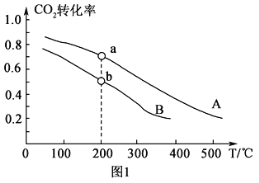
其中a点的平衡常数表达式为:__。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__。

A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g)![]() CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
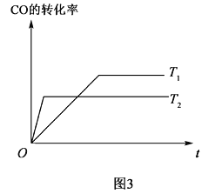
①该反应的焓变ΔH__0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___。
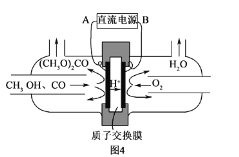
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200 ℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+![]() O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===
O2(g)===SO2(g)+H2O(g) ΔH1,2H2S(g)+SO2(g)===![]() S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
S2(g)+2H2O(g) ΔH2,H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3,2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( )
A. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)B. ΔH4=
(ΔH1+ΔH2-3ΔH3)B. ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C. ΔH4=![]() (ΔH1+ΔH2-3ΔH3)D. ΔH4=
(ΔH1+ΔH2-3ΔH3)D. ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体常用做农业和渔业的杀虫剂、杀菌剂。实验室模拟由废铜屑(含少量铁)生产硫酸铜晶体的流程如图:
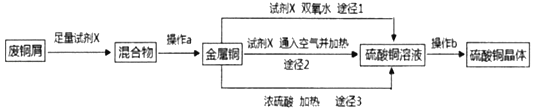
(1)试剂X是_____,操作a需要的玻璃仪器有烧杯、玻璃棒和_____。
(2)途径1是将铜加入到试剂X与双氧水的混和液中并用30~40℃水浴加热,该过程中温度不宜过高的原因是_____。
(3)途径2是将铜加入到试剂X中,再通入足量的空气并加热,该反应的化学方程式为_____。
(4)从环保和经济的角度对比途径1与途径3,途径1的优点有_____、_____。
(5)操作b包括蒸发浓缩、_____、过滤、冼涤、干燥(请补全缺少的实验步骤)。
(6)硫酸铜晶体(CuSO4xH2O)中结晶水数目可通过以下实验测定:
Ⅰ.称取4.6400g样品置于小烧杯中,加入适量水溶解,边搅拌边滴加BaCl2溶液到沉淀完全
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为4.6600g。计算CuSO4xH2O中的x值(要求写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,均含有相同的某种元素,在一定条件下,它们之间具有如下转化关系:甲![]() 乙
乙![]() 丙
丙![]() 丁。下列有关物质的推断不正确的是( )
丁。下列有关物质的推断不正确的是( )
A.若甲为C,则乙可能是CO
B.若甲为S,则丁可能是H2SO4
C.若甲为Na,则丙可能是Na2O2
D.若甲为Fe,则丁可能是Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定。回答下列问题:
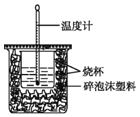
(1)该图中有一处未画出,它是_______填仪器名称)。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则根据此实验的数据书写中和热的热化学方程式中的H将____(填“偏大”“偏小”或“不变”),原因是_______。
(4)利用50 mL 0.50 mol/L的稀盐酸与50 mL 0.55 mol/L的稀氢氧化钠溶液进行实验,设溶液的密度均为1 g/cm3,中和后溶液的比热容c=4.18 J/(g·℃),请根据实验数据计算中和热H= __ (取小数点后一位)。
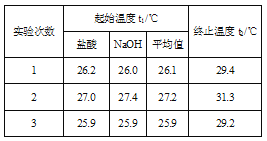
(5)上述(4)中的结果与中和热的理论值有偏差,产生偏差的原因可能是___。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
3C(g)+4D(g)反应中,表示该反应的反应速率最快的是
A.v(A)=0.5 mol·L1·min 1B.v(B)=0.1 mol·L1·s1
C.v(C)=0.8 mol·L1·min 1D.v(D)=1 mol·L1·min 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是重要的工业原料,在一定条件下可合成多种药物或医药中间体。
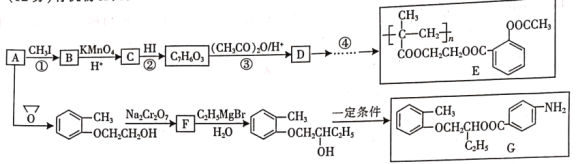
已知: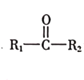
![]()
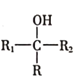
![]()
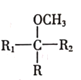 (R表示烃基,
(R表示烃基,![]() 、
、![]() 表示烃基或氢原子)。请回答:
表示烃基或氢原子)。请回答:
(1)下列说法中不正确的是__________(填字母)。
A.有机物G的分子式是![]()
B.有机物A和F均能使溴水褪色
C.合成过程中设计反应①、②的目的是保护酚羟基不被氧化
D.1mol E与足量的NaOH溶液反应,最多可以消耗4mol NaOH
(2)有机物B的结构简式是__________。
(3)反应④中的合成原料除D外,还需要的有机物是__________、__________。(写结构简式)
(4)反应③的化学方程式是__________。
(5)写出化合物F同时符合下列条件的所有可能的同分异构体的结构简式:__________。
①苯环上只有两种不同化学环境的氢原子;
②能发生水解反应,1mol该物质能消耗2mol NaOH
(6)依据提示信息,设计以A为原料制备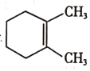 的合成路线__________(提供
的合成路线__________(提供![]() 及需要的无机试剂)。注:合成路线的书写格式参照如下示例流程图:CH3CH2OH
及需要的无机试剂)。注:合成路线的书写格式参照如下示例流程图:CH3CH2OH![]() H2C=CH2
H2C=CH2![]() BrH2C-CH2Br
BrH2C-CH2Br
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com