
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
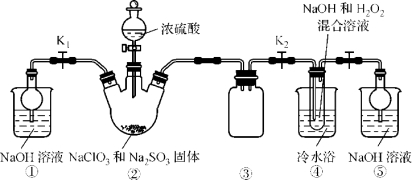
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
【答案】(1)防止倒吸 (2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O
2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 (3)用38-60 ℃的温水洗涤
(4)溶液由蓝色变为无色,且30 s内不变色 (5)![]() % (6)4I-+O2+4H+=2I2+2H2O
% (6)4I-+O2+4H+=2I2+2H2O
【解析】
试题分析:(1)装置④中气体反应,装置内压强降低,因此装置③是安全瓶能防止倒吸;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag c molL-1×V×10-3L×250mL/25mlL
所以90.5g:mag=4mol:c molL-1×V×10-3L×250mL/25mlL
解得a=![]() % ;
% ;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O。


科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列叙述不正确的是
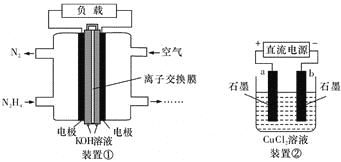
A. 该燃料电池负极发生的电极反应为:N2H4+4OH---4e-="=" N2+4H2O
B. 用该燃料电池作为装置②的直流电,产生1 mol Cl2至少需要通人 0.5 mol N2H4
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧
查看答案和解析>>
科目:高中化学 来源: 题型:
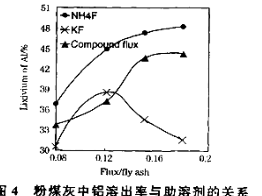
【题目】【化学—选修2:化学与技术】粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为:SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
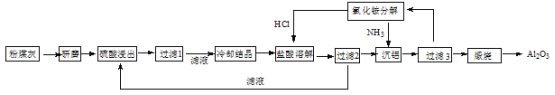
(1)粉煤灰研磨的目的是 。
(2)第1次过滤滤渣的主要成分有 和 (填化学式, 下同),第3次过滤时,滤渣的成分的是 。
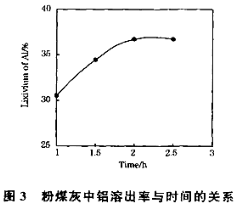
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如下图1,适宜的浸取时间为 h;铝的浸取率与“助溶剂/粉煤灰”的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及其NH4F与KF的混合物,在助溶剂/粉煤灰相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂缺点是 (举一例)。
(4)流程中循环使用的物质有 和 (填化学式)。
(5)用盐酸溶解硫酸铝晶体,能够发生的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E代表5种元素。请按要求填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为__________;其价层电子排布图为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素原子的名称为________,C离子的结构示意图为____________________________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为____________________,其原子的结构示意图为______________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子价层电子排布式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似,如:Zn既能溶于强酸又能溶于强碱溶液。
回答下列问题:
(1)步骤I中所用的试剂可以是_________。
(2)步骤III中加入H2O2的作用是做______________。(填“还原剂”或“氧化剂”)
(3)步骤V可选用的试剂是_______(填序号)。
a.NaOH溶液 b.氨水 c.适量HCl溶液
(4)步骤VI的实验操作是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素
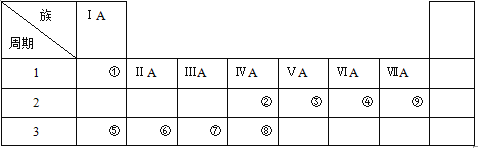
(1)①~⑨中金属性最强的元素是(填元素符号) ,非金属性最强的元素是(填元素符号) 。
(2)④、⑤、⑦的原子半径由大到小的顺序为(填元素符号) 。
(3)②、③的最高价氧化物的水化物的酸性强弱顺序为(填化学式) 。
(4)由①、④元素按原子个数比2:1组成的化合物的电子式为 。
(5)由②和④组成的化合物与⑥单质反应的化学方程式为 。
(6)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
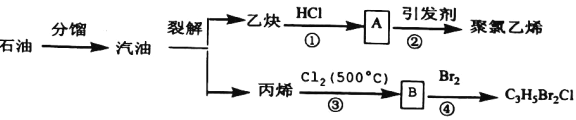
(1)写出反应②的化学方程式__________。
(2)B分子中无甲基,则B的结构简式为__________。系统命名为__________。
(3)反应①和③的类型依次是__________、__________。
(4)写出反应③化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为探究草酸的性质并制备草酸钠及其用途,查阅到如下信息:

探究草酸部分性质并制备草酸钠的生产流程如下:
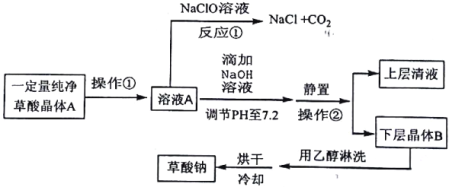
请回答下列问题:
(1)写出反应①的化学方程式__________。表明草酸具有__________性。
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是__________。该反应达到终点时的化学方程式为__________。
(3)操作②的名称是__________。用乙醇淋洗晶体B的目的是__________
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会__________:操作中需用__________滴定管(填“酸式”或“碱式”),当达到反应终点时的现象是__________;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生反应制取盐酸的设想,在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
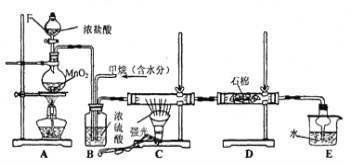
根据要求填空:
(1)装置A中反应的离子方程式为 ;
(2)B装置有三种功能:
①控制气流速度;② ;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是 ,
E装置的作用是 。
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
该装置还有缺陷,原因是没有进行尾气处理,写出尾气中的主要成分是 。
(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)实验之余,该学习小组进一步探究甲烷与氯气反应的条件。

通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按上图安装好装置,并夹紧弹簧夹a和b。过一段时间,打开弹簧夹a、b,I、II中观察到现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com