
| ||
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
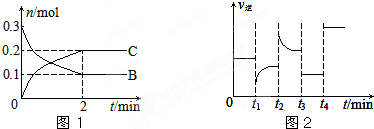
| A、x=2,反应开始2 min内,v(B)=0.1 mol/(L?min) |
| B、t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变 |
| C、t2时改变的条件可能是增大c(C),B的转化率增大 |
| D、t1时改变的条件可能是降温,A(s)的质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Kw减小 |
| B、溶液中的CO32-离子浓度一直增大 |
| C、微热反应后的溶液,溶液的pH会升高 |
| D、当恰好生成NaHCO3时,溶液中离子浓度大小存在以下关系:c(Na+)+c(H-)═c(HCO3)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaOH标准溶液滴定未知浓度的硫酸要用到:石蕊试剂、碱式滴定管、锥形瓶 |
| B、棉、丝、毛皮以及合成纤维完全燃烧只生成H2O和CO2 |
| C、油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
| D、塑料、钢化玻璃、玻璃钢都是硅酸盐制品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com