
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
【答案】 0.02mol/L 1:2 变大 ④⑥ ④ >
【解析】试题分析:(1)0~10min内容器中A的物质的量浓度变化为:0.45mol/L-0.25mol/L=0.2mol/L;0~10min内容器中C的物质的量浓度变化为:0.40mol/L,x:y=0.2mol/L:0.40mol/L=1:2。
(2)0~10min内△n(A)=0.45mol-0.25mol=0.2mol,v(A)=△c/△t=[(0.450.25)mol/L]÷10min=0.02mol·(L·min)-1。
(3)反应前气体物质的量小于反应后气体物质的量,随着反应的进行,气体物质的量增大,气体压强增大。
(4)第10min时,单位时间内A、C的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂;第16min时,C的物质的量减小,A的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度。
(5)已知第16min时改变的条件是升高温度,而该反应是放热反应,所以升高温度平衡逆移,则平衡常数减小,所以K1>K2。


科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):

(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
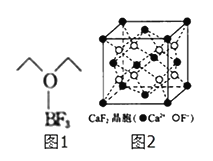
(1)基态氟原子核外电子的运动状态有__种,这些电子的电子云形状有__种;氟原子的外围电子排布式为______.
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有_____;与HF2-互为等电子体的分子有___(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为____.
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于__晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555nm.
①Ca2+、F-的配位数分别为__和__.
②列式表示氟化钙晶体的密度:_________gcm-3(不必计算出结果).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
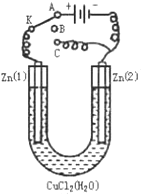
(1)如果把开关K接A,该装置应是 ,Zn(2)极是 极,电极反应式为 。
(2)上述反应进行5min后,置换开关K到C,则该装置是 ,Zn(2)极是 极,电极反应式是 。
(3)上述装置进行2min后,再置换开关K至B,则Zn(1)极发生的化学反应方程式为 ,Zn(2)极发生的有关电化学的反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:N2 + 3H2 ![]() 2NH3。
2NH3。
某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率 v(N2) = ______________。
(2)250s时,H2的转化率为________________。
(3)已知![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化_____ kJ。下图能正确表示该反应中能量变化的是_____。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化_____ kJ。下图能正确表示该反应中能量变化的是_____。

(4)为加快反应速率,可以采取的措施________________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
(5)下列叙述中能说明上述反应达到平衡状态的是_________________。
A.反应中N2与NH3的物质的量之比为1∶2
B.混合气体的总物质的量不随时间的变化而变化
C.单位时间内每消耗a mol N2,同时生成2a mol NH3
D.N2的质量分数在混合气体中保持不变
E.混合气体的平均相对分子质量保持不变
F.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某氯代烃中的氯元素,现进行如下操作,其中合理的是
①取氯代烃少许,加入AgNO3溶液 ②取氯代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 ③取氯代烃少许与NaOH水溶液共热,冷却后加入稀硝酸酸化,再加入AgNO3溶液
A. ①B. ②C. ③D. 均不合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 充电过程是化学能转化为电能的过程 B. 充电时阳极反应:Ni(OH)2-e-+OH-=NiO(OH)+H2O
C. 放电时负极附近溶液的碱性不变 D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4–和有机阳离子构成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是
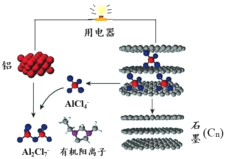
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e- + 7AlCl4– = 4Al2Cl7–
D.充电时的阳极反应为:Cn + AlCl4––e- = CnAlCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com