
【题目】氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有__种,这些电子的电子云形状有__种;氟原子的外围电子排布式为______.
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有_____;与HF2-互为等电子体的分子有___(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为____.
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于__晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555nm.
①Ca2+、F-的配位数分别为__和__.
②列式表示氟化钙晶体的密度:_________gcm-3(不必计算出结果).
【答案】 9 2 2s22p5 离子键、共价键、氢键 CO2(或N2O) sp2 分子 8 4 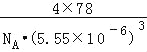
【解析】
(1)基态氟原子核外有9个电子,则其核外电子的运动状态有9种;氟原子核外含有2s轨道和p轨道两种轨道,则氟原子电子的电子云形状有2种;氟原子的外围含有7个电子,其外围电子排布式为:2s22p5。
(2)NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,所以NaHF2中所含作用力的类型有离子键、共价键、氢键;等电子体是指具有相同价电子数目和原子数目的分子或离子,根据等电子体的定义,与HF2-互为等电子体的分子有CO2(或N2O)。
(3)N2F2(二氟氮烯)分子中,氮原子形成了3个σ键和1个π键,则其杂化轨道类型为sp2。
(4)三氟化硼乙醚的熔点为-58℃,沸点为126~129℃,其熔沸点降低,应该属于分子晶体。
(5)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4。
②该晶胞中含有钙离子个数=8×1/8+6×1/2=4,氟离子在该晶胞的内部,所以氟离子个数是8,该晶胞中含有4个CaF2,该晶胞的体积为:V=(5.55×10-6)3cm3,该晶胞的密度为:ρ=m÷V=![]() gcm-3。
gcm-3。


科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂4molH—H键
C. 混合气体的平均相对分子质量不变
D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下对说法正确的是
A. 标准状况下22.4 L甲苯含有8NA个C-H键
B. 1L1 mol·L-1的Na2S溶液中含有NA个S2-
C. 46gNa与足量H2O反应完全后可生成NA个H2分子
D. 1molCu和少量浓硝酸反应完全后可生成2NA个NO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的说法正确的是( )
A. 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
B. 石油分馏是化学变化,可得到汽油、煤油
C. 石油裂化主要得到乙烯
D. 煤制水煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下,n为气体。m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 简单离子半径:Z>Y>X B. 化合物P中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应 D. 最简单气态氢化物的稳定性:W>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com