
【题目】(1)已知:H2(g)+1/2O2(g)H2O(g),反应过程中能量变化如图所示,则:
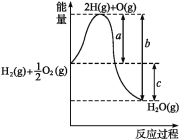
①a、b、c分别代表什么意义?
a______________________________;
b_______________________________;
c_______________________________。
②该反应是ΔH____________0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,已知:H2(g)+![]() O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)H2(l) ΔH=-0.92 kJ·mol-1
O2(g)O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式____________________________________________
【答案】1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量 H、O结合生成1 mol H2O(g)放出的热量 1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量 < H2(l)+![]() O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
【解析】
可逆反应能量变化图像中,a是反应活化能,b是产物化学键结合释放的能量,c为反应热;根据盖斯定律,液氢和液氧生成气态水ΔH=ΔH1-ΔH2-0.5ΔH3+ΔH4。
①
a——反应活化能,指1 mol H2分裂为H,0.5 mol O2分裂为O时吸收的热量;
b——H、O结合生成1 mol H2O(g)放出的热量;
c——反应热,指1 mol H2和0.5 mol O2生成1 mol H2O(g)时反应放出的热量。
②该图可知,ΔH=生成物总能量-反应物总能量<0,反应放热。
(2) 设H2(g)+![]() O2(g)H2O(l) ΔH1=-285.8 kJ·mol-1;
O2(g)H2O(l) ΔH1=-285.8 kJ·mol-1;
H2(g)H2(l) ΔH2=-0.92 kJ·mol-1;
O2(g)O2(l) ΔH3=-6.84 kJ·mol-1;
H2O(l)H2O(g) ΔH4=+44.0 kJ·mol-1,液氢和液氧生成气态水的化学方程式为H2(l)+![]() O2(l)H2O(g),ΔH=ΔH1-ΔH2-0.5ΔH3+ΔH4=-237.46 kJ·mol-1。
O2(l)H2O(g),ΔH=ΔH1-ΔH2-0.5ΔH3+ΔH4=-237.46 kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。

Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于臭氧性质的叙述中,不正确的是
A.臭氧比氧气的氧化性更强,常温下能将银、汞等较不活泼的金属氧化
B.臭氧是比氯水更好的消毒剂,因为它在消灭细菌后变成O2,无污染
C.臭氧和活性炭一样,能够吸附有机色素,是种很好的漂白剂
D.臭氧和氧气在一定条件下可以相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物结构和性质的说法错误的是
A. 分子式为C5H10O2且能与 NaHCO3反应放出气体的结构共有4种
B. 石油是混合物,可通过分馏得到汽油、煤油等纯净物
C. 苯甲酸(![]() )分子中所有原子可能位于同一平面
)分子中所有原子可能位于同一平面
D. 1mol盐酸美西律( )最多可与3 mol H2发生加成
)最多可与3 mol H2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是
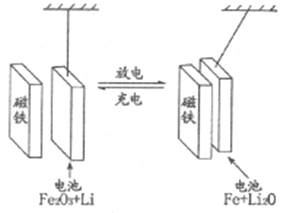
A. 放电时,负极的电极反应式为Li-e-=Li+
B. 放电时,电子通过电解质从Li流向Fe2O3
C. 充电时,Fe做阳极,电池逐渐摆脱磁铁吸引
D. 充电时,阳极的电极反应式为2Fe+3Li2O-6e-= Fe2O3+6Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸,现需240mL0.1mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为_____。
(2)配制0.1 mol·L-1的盐酸应用量筒量取浓盐酸体积____mL。
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次,并将所缺内容填在横线上)______。
A.用30 mL蒸馏水洗涤____ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 _____加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线____处
(4)若实验过程中出现如下情况,所配溶液浓度将会怎样?(填偏高或偏低)
①加蒸馏水时不慎超过刻度线_____②量取浓盐酸时仰视______③定容时俯视_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
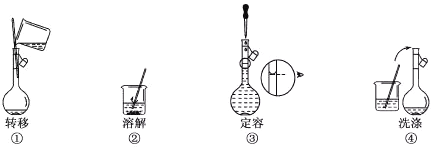
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com