
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
【答案】D
【解析】
先把题中提供的量都分别转化为各物质的物质的量,然后再比较它们的体积、密度等。标准状况下6.72LCH4的物质的量为0.3mol,3.01×1023个HCl分子的物质的量为0.5mol,13.6gH2S的物质的量为0.4mol,然后进行比较即可得出结论。
①6.72LCH4的物质的量n= ![]() =0.3mol;
=0.3mol;
②3.01×1023个HCl的物质的量n= ![]() =0.5mol;
=0.5mol;
③13.6gH2S的物质的量n= ![]() =0.4mol;
=0.4mol;
④0.2molNH3;
a.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积②>③>①>④,故a正确;
b.根据ρ=![]() 知,相同条件下,密度之比等于摩尔质量之比,故密度②>③>④>①,故b正确;
知,相同条件下,密度之比等于摩尔质量之比,故密度②>③>④>①,故b正确;
c.根据m=nM知,甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量②>③>①>④,故c正确;
d.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目①>③>④>②,故d正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
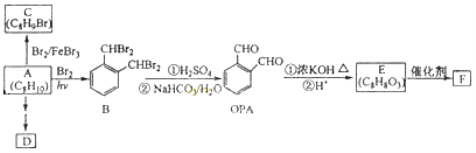
回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线 ;
(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为 ,该反应的化学方程式为 。(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
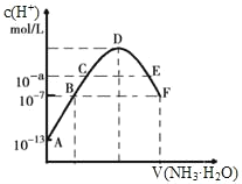
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,可用于催熟果实。根据以下化学反应框图填空:
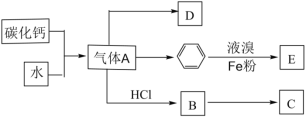
(1)写出A的电子式_______;C的结构简式_______;D中碳原子的杂化方式为_______
(2)写出苯和液溴反应生成E的化学方程式_______;其反应类型是_______;
(3)B中最多有_______个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.NH3![]() NO2
NO2![]() HNO3
HNO3
B.Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() 无水MgCl2
无水MgCl2
C.Fe2O3![]() Fe
Fe![]() FeCl2
FeCl2
D.NaCl(aq) ![]() NaOH(aq)
NaOH(aq) ![]() NaHCO3
NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
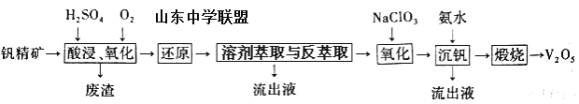
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含![]() 等物质,从中分离提取钒铬的工艺流程如下:
等物质,从中分离提取钒铬的工艺流程如下:

回答下列问题:
(1)“焙烧”时会生成![]() 和
和![]() ,生成
,生成![]() 的化学方程式是_________________________。
的化学方程式是_________________________。
(2)滤渣1中主要含_________________。滤渣2的主要成分是![]() 和
和![]() ,要使所得滤液中含有的相关金属离子浓度小于
,要使所得滤液中含有的相关金属离子浓度小于![]() ,应调
,应调![]() 不低于___。(已知:
不低于___。(已知:![]()
![]()
(3)“沉钒”所用![]() 溶液中,离子浓度由大到小的顺序是_________________________。
溶液中,离子浓度由大到小的顺序是_________________________。
(4)“还原”时溶液的![]() 在2.5左右,此时控制酸度应选用_______________(填字母标号)。
在2.5左右,此时控制酸度应选用_______________(填字母标号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铵
(5)![]() 煅烧时发生反应的类型是否相同?____________(填“相同”或“不同”)
煅烧时发生反应的类型是否相同?____________(填“相同”或“不同”)
(6)工业上可用电解还原法处理含![]() 的酸性废水。用铁板作阳极,电解过程中,废水
的酸性废水。用铁板作阳极,电解过程中,废水![]() 逐渐上升
逐渐上升![]() 都以氢氧化物沉淀析出,达到废水净化的目的。
都以氢氧化物沉淀析出,达到废水净化的目的。
①其中阳极的电极反应式是_________________________。
②电解过程中,废水![]() 上升的原因是________________________________________________。
上升的原因是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com