
【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
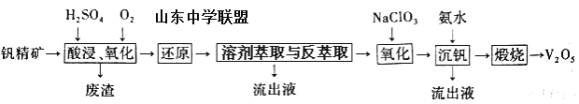
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。
【答案】2V2O3+8H++O2=4VO2++4H2O V2O5+6HCl(浓)=2VOCl2+Cl2+3H2O 铁粉 硫氰酸钾溶液 酸 0.5 V2O5+5Ca![]() 2V+5CaO
2V+5CaO
【解析】
钒精矿经硫酸酸浸、氧气氧化得到滤液和废渣,滤液中主要阳离子有VO2+、VO2+、Fe3+、K+、Al3+,滤渣主要为SiO2;萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用铁粉将铁离子还原成亚铁离子,同时也将VO2+还原成VO2+,再经“溶剂萃取与反萃取”得到含VO2+的溶液,然后利用NaClO3将VO2+氧化成VO2+,加入氨水得到NH4VO3沉淀,煅烧得到五氧化二钒。
(1)“酸浸、氧化”时,V2O3转化为VO2+,该过程中氧气做氧化剂,V2O3为还原剂,结合电子守恒和元素守恒可得方程式为2V2O3+8H++O2=4VO2++4H2O;浓盐酸为还原性酸,V2O5转化为VO2+,同时将盐酸氧化成氯气,结合电子守恒和元素守恒可知方程为V2O5+6HCl(浓)=2VOCl2+Cl2+3H2O;
(2)根据分析可知萃取前可用铁粉对浸出液进行“还原”处理;铁离子与硫氰酸钾溶液反应呈红色,可用硫氰酸钾溶液检验是否含有铁离子;
(3)为了提高VO2+的产率需要平衡左移,则需要溶液中有大量氢离子,所以反萃取剂应呈酸性;
(4)VO2+变为VO2+,化合价升高1价,则使3molVO2+变为VO2+需要转移3mol电子,氧化剂NaClO3被还原成Cl-,化合价降低6价,所以转移3mol电子需要0.5molNaClO3;
(5)该过程中高温条件下钙还原五氧化二钒得到单质钒,方程式为V2O5+5Ca![]() 2V+5CaO。
2V+5CaO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol·L-1的KOH溶液滴定10mL0.1mol·L-1的H2C2O4溶液,所得滴定曲线如图所示。忽略混合时溶液体积的变化,下列有关各点溶液中粒子浓度关系正确的是
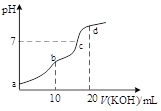
A.a点溶液中:c(H+)=0.1mol·L-1+c(OH-)-c(H2C2O4)+c(C2O42-)
B.b点溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.c点溶液中:c(K+)<c(C2O42-)-c(H2C2O4)+0.1mol·L-1
D.d点溶液中:c(OH-)-c(H+)=c(H2C2O4)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种药物合成中间体,其合成路线如下:
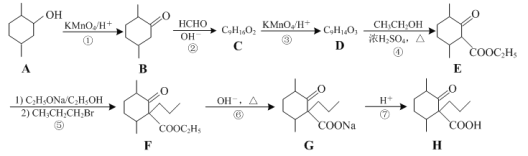
(1)A→B的反应的类型是____________反应。
(2)化合物H中所含官能团的名称是____________和____________。
(3)化合物C的结构简式为___________。B→C反应时会生成一种与C互为同分异构体的副产物,该副产物的结构简式为___________。
(4)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①能发生水解反应,所得两种水解产物均含有3种化学环境不同的氢;
②分子中含有六元环,能使溴的四氯化碳溶液褪色。
(5)已知:![]() CH3CH2OH。写出以环氧乙烷(
CH3CH2OH。写出以环氧乙烷(![]() )、
)、![]() 、乙醇和乙醇钠为原料制备
、乙醇和乙醇钠为原料制备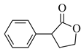 的合成路线流程图_______________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦对新型冠状病毒(COVID-19)有明显抑制作用。K是合成瑞德西韦的关键中间体,其合成路线如下:
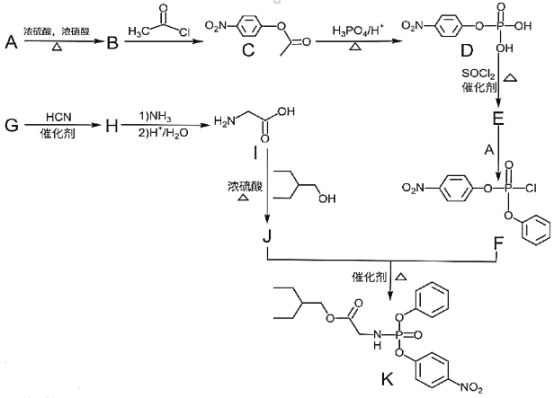
①R-OH![]() R-Cl;
R-Cl;
②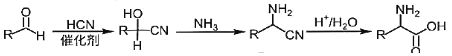
回答下列问题:
(1)B的结构简式为_________________________,B→C的反应类型为_____________,J中含氧官能团的名称为_______________,G→H的反应化学方程式为_____________________________________________。
(2)写出符合下列条件的C的同分异构体X__________________________(填结构简式,不考虑立体异构)。
①苯环上含有硝基且苯环上只有一种氢原子; ②与FeCl3溶液发生显色反应; ③1molX与足量金属Na反应可生成2g H2 。
(3)E中含两个Cl原子,则E的结构简式为________________________________________________。
(4)写出以苯甲醇为原料制备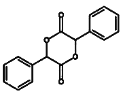 的合成路线(其它试剂任选):________________。
的合成路线(其它试剂任选):________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com