
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.NH3![]() NO2
NO2![]() HNO3
HNO3
B.Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() 无水MgCl2
无水MgCl2
C.Fe2O3![]() Fe
Fe![]() FeCl2
FeCl2
D.NaCl(aq) ![]() NaOH(aq)
NaOH(aq) ![]() NaHCO3
NaHCO3
科目:高中化学 来源: 题型:
【题目】某体系中存在如下反应:①H2S+4H2O-8e = SO42-+10H+,②2IO3-+12 H++10e = I2+6H2O。
(1)反应①中H2S做_____剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成______g I2。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:_____。
(4)由上述反应可推知__________。
a.氧化性:K2SO4> KIO3 b.酸性:HIO3> H2SO4
c.还原性:H2S > I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72LCH4,②3.01×1023个HCl分子,③13.6gH2S,④0.2molNH3。下列对这四种气体的描述正确的是( )
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.abcB.bcdC.abdD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由MnS矿(还含少量FeCO3、MgO等)制备高纯硫酸锰,工艺如图所示:
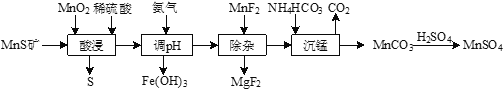
已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.8 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 3.2 | 10.9 |
(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为_____________。
(2)“酸浸”时MnO2应过量,目的是____________和将Fe2+氧化为Fe3+。
(3)已知Ksp[Fe(OH)3]=4×10-38。常温下,当溶液的pH=2时,c(Fe3+)=______________mol·L-1。
(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是_______________。
(5)“沉锰”反应的化学方程式为_____________。

(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO42-的浓度随反应时间t变化如图。导致Mn2+、SO42-浓度变化产生明显差异的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1mol·L-1的KOH溶液滴定10mL0.1mol·L-1的H2C2O4溶液,所得滴定曲线如图所示。忽略混合时溶液体积的变化,下列有关各点溶液中粒子浓度关系正确的是
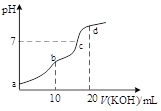
A.a点溶液中:c(H+)=0.1mol·L-1+c(OH-)-c(H2C2O4)+c(C2O42-)
B.b点溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.c点溶液中:c(K+)<c(C2O42-)-c(H2C2O4)+0.1mol·L-1
D.d点溶液中:c(OH-)-c(H+)=c(H2C2O4)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种药物合成中间体,其合成路线如下:
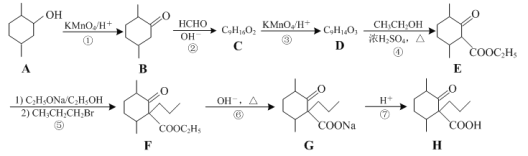
(1)A→B的反应的类型是____________反应。
(2)化合物H中所含官能团的名称是____________和____________。
(3)化合物C的结构简式为___________。B→C反应时会生成一种与C互为同分异构体的副产物,该副产物的结构简式为___________。
(4)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①能发生水解反应,所得两种水解产物均含有3种化学环境不同的氢;
②分子中含有六元环,能使溴的四氯化碳溶液褪色。
(5)已知:![]() CH3CH2OH。写出以环氧乙烷(
CH3CH2OH。写出以环氧乙烷(![]() )、
)、![]() 、乙醇和乙醇钠为原料制备
、乙醇和乙醇钠为原料制备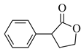 的合成路线流程图_______________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com