
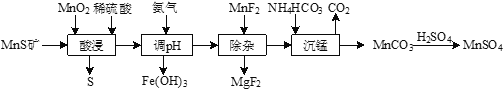
【题目】工业上由MnS矿(还含少量FeCO3、MgO等)制备高纯硫酸锰,工艺如图所示:
已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.8 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 3.2 | 10.9 |
(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为_____________。
(2)“酸浸”时MnO2应过量,目的是____________和将Fe2+氧化为Fe3+。
(3)已知Ksp[Fe(OH)3]=4×10-38。常温下,当溶液的pH=2时,c(Fe3+)=______________mol·L-1。
(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是_______________。
(5)“沉锰”反应的化学方程式为_____________。

(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO42-的浓度随反应时间t变化如图。导致Mn2+、SO42-浓度变化产生明显差异的原因是_____________。
【答案】MnS+MnO2+4H+=S+2Mn2++2H2O 提高MnS的转化率 4×10-2 H+与F-/反应生成弱酸HF 2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O Mn2+催化O2与H2SO3反应生成H2SO4
【解析】
(1)“酸浸”过程中,MnS与MnO2反应生成硫单质,硫酸锰和水;
(2)根据金属沉淀的pH进行分析;
(3) 根据Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)进行计算;
(4) “除杂”时若溶液pH过低,H+与F-反应生成弱酸HF;
(5) “沉锰”时,碳酸氢铵与硫酸锰反应生成碳酸锰、硫酸铵、二氧化碳和水;
(6) Mn2+催化O2与H2SO3反应生成H2SO4。
(1)“酸浸”过程中,MnS与MnO2反应生成硫单质,硫酸锰和水,反应的离子方程式为MnS+MnO2+4H+=S+2Mn2++2H2O;
(2)为提高MnS的转化率和将Fe2+氧化为Fe3+,“酸浸”时MnO2应过量;
(3)常温下,当溶液的pH=2时,c(H+)=10-2mol·L-1,c(OH-)=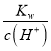 =10-12mol·L-1,Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=c(Fe3+)×(10-12mol·L-1)3=4×10-38,解得c(Fe3+)=4×10-2mol·L-1;
=10-12mol·L-1,Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=c(Fe3+)×(10-12mol·L-1)3=4×10-38,解得c(Fe3+)=4×10-2mol·L-1;
(4)“除杂”时若溶液pH过低,H+与F-反应生成弱酸HF ,Mg2+沉淀不完全;
(5)根据流程可知,“沉锰”时,碳酸氢铵与硫酸锰反应生成碳酸锰、硫酸铵、二氧化碳和水,反应的化学方程式为2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O;
(6)将SO2和空气的混合气通入MnO2悬浊液,Mn2+催化O2与H2SO3反应生成H2SO4,导致Mn2+、SO42-浓度迅速增大。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g)+![]() O2(g)=SO2(g)+H2O(g) ΔH1
O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=![]() S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
③H2S(g)+![]() O2(g)=S(g)+H2O(g) ΔH3
O2(g)=S(g)+H2O(g) ΔH3
④2S(g)=S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1 +ΔH2-3ΔH3)
(ΔH1 +ΔH2-3ΔH3)
B.ΔH4=![]() (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4=![]() (ΔH1-ΔH2+3ΔH3)
(ΔH1-ΔH2+3ΔH3)
D.ΔH4=![]() (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
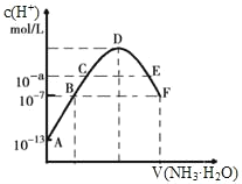
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
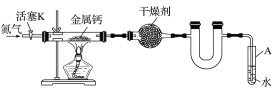
按图连接好实验装置。检查装置的气密性,方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.NH3![]() NO2
NO2![]() HNO3
HNO3
B.Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() 无水MgCl2
无水MgCl2
C.Fe2O3![]() Fe
Fe![]() FeCl2
FeCl2
D.NaCl(aq) ![]() NaOH(aq)
NaOH(aq) ![]() NaHCO3
NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[(NH4)xFey(SO4)znH2O]是一种重要铁盐,实验室采用废铁屑来制备硫酸铁铵的流程如下:
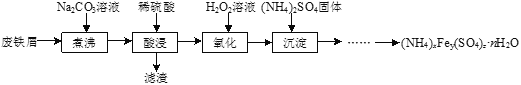
(1)将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,原理是_____________。
(2)“氧化”过程需使用足量的H2O2,同时溶液要保持pH小于0.5,目的是__________。
(3)化学兴趣小组用如下方法测定硫酸铁铵晶体的化学式:
步骤1:准确称取样品28.92 g,溶于水配成100 mL溶液。
步骤2:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入适量稀硫酸,滴加过量的SnCl2溶液(Sn2+与Fe3+反应生成Sn4+和Fe2+),充分反应后除去过量的Sn2+。用0.1000molL-1的K2Cr2O7溶液滴定Fe2+,滴定至终点时消耗K2Cr2O7溶液25.00 mL。(滴定过程中Cr2O72-转化成Cr3+)
步骤3:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入过量的BaCl2溶液,将所得白色沉淀过滤、洗涤、干燥后称量,所得固体质量为6.99 g。
①排除装有K2Cr2O7溶液的滴定管尖嘴处气泡的方法是_________。
②通过计算确定该硫酸铁铵的化学式____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。
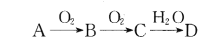
下列说法不正确的是
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族
C. 若A是共价化合物,则A和D有可能发生氧化还原反应
D. 若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com