
【题目】下列说法不正确的是 ( )
① C2H6分子中既含极性键又含非极性键
② 若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑦原子序数为34号的元素属于长周期的副族元素
A.②⑤⑦B.①③④⑤C.②④⑤⑥D.③⑤⑥⑦
【答案】A
【解析】
①C2H6分子中碳元素和碳元素之间形成非极性共价键,碳元素和氢元素之间形成极性共价键,故①正确;
②R2-和M+的电子层结构相同,则离子的核外电子数相等,且M处于R相邻的下一周期;所以原子序数:M>R,故②错误;
③F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量增大而升高,故③正确;
④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构,故④正确;
⑤若X的质子数为a,中子数为b,则原子可表示为![]() ,故⑤错误;
,故⑤错误;
⑥由于氨和水分子之间能形成氢键,使得NH3溶解度大,故⑥正确;
⑦原子序数为34号的元素为Se,属于长周期的主族元素,不是副族元素,故⑦错误;
②⑤⑦错误,答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
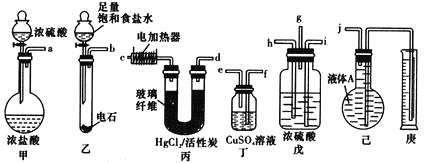
(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Kap[Cu(OH)2]<Kap[Fe(OH)2]下列说法中正确的是
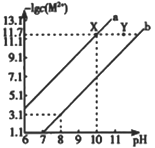
A. a线表示Fe(OH)2饱和溶液中的变化关系
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C. 除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:___
(2)铝与NaOH溶液反应的离子方程式为:___。
(3)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
①I和II步骤中分离溶液和沉淀的操作是;___;
②沉淀M中除含有泥沙外,一定还含有___,固体N是___;
③滤液X中,含铝元素的溶质的化学式为___,它属于___(填“酸”、“碱”或“盐”)类物质;
④实验室里常往AlCl3溶液中加入___(填“氨水”或“NaOH溶液”)来制取A1(OH)3。其反应的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铁、氧化亚铁和氧化铁的混合粉末中,加入100ml2mol/L的盐酸,恰好使混合物完全溶解,并放出448ml的气体(SPT),在所得溶液中加入KSCN溶液无血红色出现.若用相同质量的上述混合物粉末高温下同足量的一氧化碳反应,可得到铁的质量是( )
A.无法计算B.2.8gC.5.6gD.11.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行Fe2+与Fe3+转化实验:向FeCl2溶液中加入少量KSCN溶液,溶液无明显变化,再加入少量双氧水,溶液变红,继续滴加至过量,发现溶液红色褪去,同时有气泡生成.他们针对此异常现象展开探究,请回答有关问题:
(1)该小组对于产生气体的原因有两种猜测:
猜测一:__________________________________________。
猜测二:红色褪去可能是SCN-被H2O2氧化,同时产生的气体中可能含有氮气、二氧化碳、二氧化硫。
(2)化学小组针对猜测二设计下面的实验来验证气体成分:
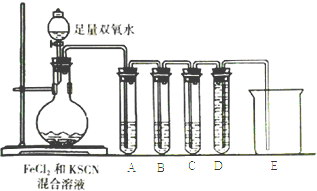
①试管A中盛放品红溶液,若实验中品红溶液褪色,证明气体中含有____________;
②试管B中的溶液是酸性高锰酸钾溶液,其目的是________________,预期试管B中的现象是________________________________。
③试管C中盛有澄清石灰水,目的是___________________;试管D和烧杯的作用是______________。④以上实验证明SCN-能被H2O2氧化.请写出该反应的离子方程式:___________________________________。
(3)根据题目信息及以上实验推断,Fe2+和SCN-中还原性较强的是_______,理由是_________。
(4)有人认为SCN-的氧化产物可能还有硫酸根离子,请设计一个简单实验证明该假设是否正确_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列叙述不正确的是( )

A. K与N连接时,铁被腐蚀
B. K与N连接时,石墨电极产生气泡
C. K与M连接时,一段时间后溶液的pH增大
D. K与M连接时,开始阶段石墨电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,将气体X、Y充入2 L密闭容器中反应生成气体Z。若各气体的物质的量随时间变化曲线如图所示,下列描述正确的是( )

A.前10s内 v(X)=0.08mol·L-1·s-1
B.该反应的平衡常数K=32
C.平衡时X、Y的转化率相同
D.达到平衡后,将容器体积扩大为 4 L,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com