
【题目】电石法(乙炔法)制氯乙烯是最早完成工业化的生产氯乙烯的方法。
反应原理为HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知
CH2=CHCl(HgCl2/活性炭作催化剂)。某学习小组的同学用下列装置测定该反应中乙炔的转化率(不考虑其他副反应)。铁架台及夹持仪器未画出。(已知![]() 的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
的熔点为-159.8℃,沸点为-134℃。乙炔、氯乙烯、氯化氢均不溶于液体A)
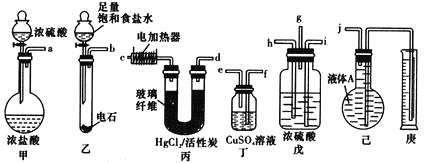
(1)各装置的连接顺序为(箭头方向即为气流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊装置除了均匀混合气体之外,还有_________和_________的作用。
(3)乙装置中发生反应的化学方程式为_________________________________。
(4)若实验所用的电石中含有1.28gCaC2,甲装置中产生0.02mol的HCl气体。则所选用的量筒的容积较合理的是_______![]() 填字母代号
填字母代号![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在标准状况下测得庚中收集到的液体A的体积为672ml(导管内气体体积忽略不计),则乙炔的转化率为_________。
【答案】![]() f e g c d j 干燥气体 观察气体流速
f e g c d j 干燥气体 观察气体流速 ![]()
![]() 50%
50%
【解析】
(1)根据反应过程可知,装置乙的作用为制取乙炔,利用装置丁除去杂质后,在戊装置中干燥、控制气体流速以及使气体混合均匀,在装置丙中发生反应后生成氯乙烯,利用装置己和庚测定气体的体积,据此连接装置;
(2)装置乙中制得的乙炔,利用装置丁除去杂质后,与装置甲制得的HCl在戊装置中干燥、控制气体流速以及使气体混合均匀后在装置丙中发生反应后生成氯乙烯,由此确定装置戊的作用;
(3)乙装置中发生的反应为电石与水生成乙炔和氢氧化钙;
(4)碳化钙的物质的量为![]() ,可计算出0.02molHCl反应产生的氯乙烯在标准状况下的体积,再考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 据此选择量筒的体积;
,可计算出0.02molHCl反应产生的氯乙烯在标准状况下的体积,再考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 据此选择量筒的体积;
(5)碳化钙的物质的量为![]() ,可计算出乙炔与0.02molHCl气体的总体积,乙炔、氯乙烯、氯化氢均不溶于液体A,由此可计算出乙炔的转化率。
,可计算出乙炔与0.02molHCl气体的总体积,乙炔、氯乙烯、氯化氢均不溶于液体A,由此可计算出乙炔的转化率。
(1)根据给定装置图分析可知甲装置用于制取氯化氢,乙装置用于制取乙炔,丙装置用于氯乙烯的制备,丁装置用于除去乙炔中的杂质,戊装置用于干燥、控制气体流速以及使气体混合均匀,己和庚用于测定气体的体积,所以装置的连接顺序为:b;f;e;g; c;d;j;
(2)戊装置用于干燥、控制气体流速以及使气体混合均匀等;
(3)碳化钙与水反应的化学方程式为:![]() ;
;
(4)碳化钙的物质的量为![]() ,与0.02molHCl反应产生的氯乙烯在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448ml,考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 所以应选取1000mL的量筒;
,与0.02molHCl反应产生的氯乙烯在标准状况下的体积为0.02mol×22.4L/mol=0.448L=448ml,考虑乙炔不能全部转化及乙炔、氯乙烯、氯化氢均不溶于液体A, 所以应选取1000mL的量筒;
(5)碳化钙的物质的量为![]() ,故乙炔与0.02molHCl气体的总体积在标准状况下为(0.02mol+0.02mol) ×22.4L/mol=0.896L=896mL,乙炔、氯乙烯、氯化氢均不溶于液体A,所以乙炔的转化率为
,故乙炔与0.02molHCl气体的总体积在标准状况下为(0.02mol+0.02mol) ×22.4L/mol=0.896L=896mL,乙炔、氯乙烯、氯化氢均不溶于液体A,所以乙炔的转化率为![]() 。
。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
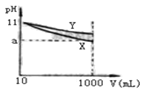
A. X、Y两种碱的物质的量浓度一定相等
B. 稀释后,X溶液碱性比Y溶液碱性强
C. 若9<a<11,则X、Y都是弱碱
D. 完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl的溶解平衡曲线如图所示。已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。下列说法错误的是
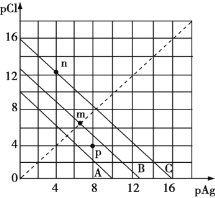
A. A线、B线、C线对应的温度关系:A>B>C
B. A线对应温度下,AgCl的Ksp=1×10-10
C. B线对应温度下,p点形成的溶液是AgCl的不饱和溶液
D. C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将C12缓慢通入100 mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol·L-1 NaOH溶液,整个过程溶液中H+的浓度变化如图所示。(已知常温常压下C12溶于水时,只有部分C12会和水发生反应)下列叙述正确的是

A. ①处溶液的酸性比②处溶液的酸性强
B. 依据②处c(H+)可计算溶解的C12的物质的量
C. 整个实验过程中,溶液的颜色先变深后变浅,最后变为无色
D. ④处表示C12与NaOH溶液恰好完全反应,共转移了0.1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.10 mol/L CuCl2溶液中滴加0.10mol/L Na2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是

A. Ksp(CuS)的数量级为10-21
B. 曲线上a点溶液中,c(S2-)c(Cu2+) > Ksp(CuS)
C. a、b、c三点溶液中,n(H+)和n(OH-)的积最小的为b点
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是药物合成中的一种重要中间体,下面是H的一种合成路线:


回答下列问题:
(1)X的结构简式为_______,其中所含官能团的名称为______;Y生成Z的反应类型为_______。
(2)R的化学名称是________。
(3)由Z和E合成F的化学方程式为__________________。
(4)同时满足苯环上有4个取代基,且既能发生银镜反应,又能发生水解反应的Y的同分异构体有________种,其中核磁共振氢谱上有4组峰,峰面积之比为1∶2∶2∶3的同分异构体的结构简式为________(一种即可)。
(5)参照上述合成路线,以乙醛和![]() 为原料(其他试剂任选),设计制备肉桂醛(
为原料(其他试剂任选),设计制备肉桂醛(![]() )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
① C2H6分子中既含极性键又含非极性键
② 若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑦原子序数为34号的元素属于长周期的副族元素
A.②⑤⑦B.①③④⑤C.②④⑤⑥D.③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com