
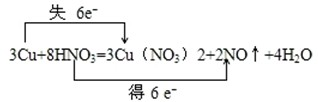
 ,
, ;
;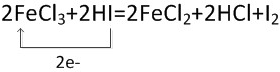 ,故答案为:
,故答案为: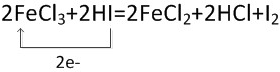 .
.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
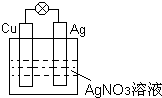 I.①如图所示,负极材料是
I.①如图所示,负极材料是查看答案和解析>>
科目:高中化学 来源: 题型:
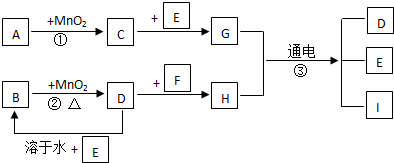
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 拆开化学键 | 形成化学键 | 则上述反应中能量变化是多少(列出计算式)?是放热还是吸热? |
| 2mol H2中的化学键 | 4mol H-O键 | |
| 1mol O2中的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | 达平衡时CO的转化率 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8kJ | α1 |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | α2 |
. |
| v |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶于水后得到的溶液能导电的物质 |
| B、BaSO4、AgCl是难溶物,但它们是电解质 |
| C、盐酸、氨水、CO2都是电解质 |
| D、在水溶液中或熔融状态下能导电的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com