
| 拆开化学键 | 形成化学键 | 则上述反应中能量变化是多少(列出计算式)?是放热还是吸热? |
| 2mol H2中的化学键 | 4mol H-O键 | |
| 1mol O2中的化学键 |
| 12558kJ×180g |
| 2804.6kJ |


科目:高中化学 来源: 题型:
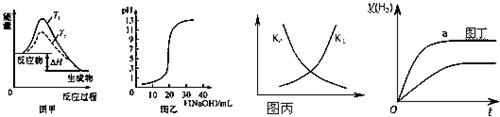
| A、图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 |
| B、图乙表示0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得到的滴定曲线 |
| C、图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图丁表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
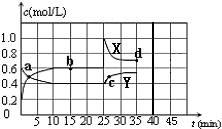 已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:
已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
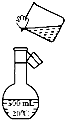 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沉淀中只有Fe(OH)3 |
| B、沉淀中有Fe(OH)3和Fe(OH)2 |
| C、滤液c(Fe3+)=4.0×10-8mol/L |
| D、向滤液中滴加FeCl2溶液,无沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com