���㣺��Ӧ�Ⱥ��ʱ�,��ѧ����ʽ���йؼ���,�Ȼ�ѧ����ʽ,�û�ѧƽ�ⳣ�����м���,��ѧƽ���Ӱ������
ר�⣺�����������������
��������1����Ϸ�Ӧ���Ⱥ����Ȼ�ѧ����ʽ��������ˮ�����ʵ��������ݷ�Ӧ����=
���㷴Ӧ���ʣ���Ӧ�Ƿ��ȷ�Ӧ�����ݷ�Ӧǰ�������غ�����жϣ�
��2�����ݷ�Ӧ�������仯����Ȼ�ѧ����ʽ��������һ����̼���ʵ�������ת���ʣ�
��3����Ӧ�ںͷ�Ӧ������ͬ�¶��½��У�ƽ�ⳣ�����䣬���ݻ�ѧƽ������ʽ����ƽ��Ũ�ȣ����ƽ�ⳣ���������õ���
��4��a����Ӧǰ������������䣬��Ӧ�٢�����ͬƽ������жϣ�
b����Ӧ�ǿ��淴Ӧ���ܽ��г��ף�
c����Ӧ��ʼŨ�Ȳ�ͬ��Ӧ���ʲ�ͬ��
d����Ӧ�����ǵ�λʱ���ڷ�Ӧ��Ũ�ȼ�С������Ӱ�컯ѧƽ������ط����жϣ�
��5��CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol��2H
2��g��+O
2��g���T2H
2O ��g����H=-484kJ/mol�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��6�����ݶ�����̼���������Ʒ�Ӧ�Ķ�����ϵ�����жϲ����д���ӷ���ʽ��CO
2+2OH
-=CO
32-+H
2O��CO
2+OH
-=HCO
3-�������������ʵ���֮��ֱƽ��д�������ݶ�����ϵ�����������ʵ�����
���
�⣺��1����װ���з�Ӧ�ų�20.5kJ������ʱ2min�����ݷ�Ӧ���㣬CO��g��+H
2O��g���TCO
2��g��+H
2��g����H=-41kJ/mol
��ʱ�������ˮ���ʵ���Ϊ��
mol=0.5mol���˶�ʱ���ڵķ�Ӧ����
��H
20��=
=0.5mol/L?min��
�������������֪��Ӧ�Ƿ��ȷ�Ӧ����Ӧ������������������������Ӧ����ӻ�ѧ������ʱ�����յ�������С���������� ��ѧ���γ����ų���������
�ʴ�Ϊ��0.5mol/L?min��С�ڣ�
��2�����ݷ�Ӧ���Ȼ�ѧ����ʽ���㣻
CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol
��ʼ����mol�� 4 1 0 0 41KJ
�仯����mol�� 0.8 0.8 0.8 0.8 32.8KJ
ƽ������mol�� 3.2 0.2 0.8 0.8
һ����̼ƽ��ת����=
��100%=20%
�ʴ�Ϊ��20%��
��3����Ӧ�٢�����ͬ�¶��½��У�ƽ�ⳣ����ͬ�����ݣ�2�����ƽ�ⳣ��������㣬��Ӧǰ�����������ͬ�������������ʵ�������ƽ��Ũ�ȼ���ƽ�ⳣ����K=
=
=1��
�ʴ�Ϊ��1��
��4��a����Ӧǰ������������䣬��Ӧ�٢�����ͬƽ�⣬ƽ��ʱ����������H
2�����������ȣ���a��ȷ��
b����Ӧ�ǿ��淴Ӧ���ܽ��г��ף��������з�Ӧ��ƽ��״̬ʱ��Q=65.6kJ����b����
c����Ӧ��ʼŨ�Ȳ�ͬ����Ӧ���ʲ�ͬ����c����
d����Ӧ�ںͷ�Ӧ����ȣ���ʼ������һ�����൱������ƽ��ѹǿ�����Ԣ٢ڴﵽ��ͬƽ��״̬����Ӧ�ﵽƽ��ʱ�����̣�t
1��t
2����Ӧǰ������������䣬����ƽ�ⲻ�䣬��Ӧ��һ����̼ת���ʲ��䣬��
1=��
2����d��ȷ��
�ʴ�Ϊ��ad��
��5����CO��g��+H
2O��g��?CO
2��g��+H
2��g����H=-41kJ/mol����2H
2��g��+O
2��g���T2H
2O ��g����H=-484kJ/mol��
���ݸ�˹���ɢ١�2+�ڵõ� 2CO��g��+O
2��g���T2CO
2��g����H=-566 kJ/mol��
�ʴ�Ϊ��2CO��g��+O
2��g���T2CO
2��g����H=-566 kJ/mol��
��6��n��CO
2��=0��6mol��n��OH
-��=0.2ml��5mol/L=1mol��
CO
2+2OH
-=CO
32-+H
2O��CO
2+OH
-=HCO
3-��
���ݷ�Ӧn��CO
2����n��OH
-��=0.6��1=3��5��֪��Ӧ���ɲ�����̼���ƺ�̼�����ƣ��������ʵ���֮�ȣ�����ֱƽ���õ����ӷ���ʽ��3CO
2+5OH
-=2CO
32-+HCO
3-+2H
2O����Ӧ���ɵ�̼����Na
2CO
3���ʵ���Ϊ0.4mol��NaHCO
3���ʵ���0.2mol��
�ʴ�Ϊ��0.4molNa
2CO
3 0.2molNaHCO
3��
���������⿼�鷴Ӧ�����仯����˹���ɼ���Ӧ�ã���ѧƽ���Ӱ�����ط����жϣ�ƽ���жϺ�ƽ�ⳣ���ļ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



 ��У����ϵ�д�
��У����ϵ�д�
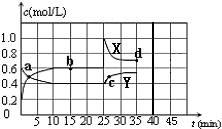 ��֪��2NO2��g��?N2O4��g������H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ����ش�
��֪��2NO2��g��?N2O4��g������H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ����ش� ijͬѧ�ù���NaOH����1000mL 0.40mol/L��NaOH��Һ���ش��������⣺
ijͬѧ�ù���NaOH����1000mL 0.40mol/L��NaOH��Һ���ش��������⣺