
| 反应序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、反应①的其余产物为H2O和O2 |
| B、反应②中Cl2与FeBr2的物质的量之比为1:2 |
| C、反应③中生成1 mol Cl2,转移电子2 mol |
| D、氧化性由强到弱的顺序为Cl2>MnO4->Br2 |


科目:高中化学 来源: 题型:
| n(H2) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从上述两反应可知1mol的I2(g)能量比1mol的I2(s)能量高 |
| B、I2(s)?I2(g)△H<0 |
| C、②的反应物总能量与①的反应物总能量相等 |
| D、1 mol I2(g)中通入1 mol H2(g),发生反应时放出的热量为9.48 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如下图所示,下列说法正确的是( )
二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如下图所示,下列说法正确的是( )| A、二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键 |
B、1mol环戊二烯(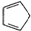 )中含有σ键的数目为5NA )中含有σ键的数目为5NA |
| C、分子中存在π键 |
| D、Fe2+的电子排布式为1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,还和胶体的知识有关 |
| B、从海水中提取食盐的过程,实际上就是蒸发海水、食盐晶体结晶析出的过程 |
| C、把大豆磨碎后,用水溶解其中的可溶性成分,经过滤后,分成豆浆和豆渣 |
| D、厨房中色拉油与凉开水混在一起,可采用过滤的方法进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molCl2参加反应转移电子数一定为2NA | ||
| B、标准状况下,22.4L空气含有NA个单质分子 | ||
C、在36g
| ||
| D、0.5 mol?L-1AlCl3中含有Cl-数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象与结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com