
| A、从上述两反应可知1mol的I2(g)能量比1mol的I2(s)能量高 |
| B、I2(s)?I2(g)△H<0 |
| C、②的反应物总能量与①的反应物总能量相等 |
| D、1 mol I2(g)中通入1 mol H2(g),发生反应时放出的热量为9.48 kJ?mol-1 |


科目:高中化学 来源: 题型:
| A、在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出 |
| B、往氯化银的悬浊液中加硝酸银,c(Cl-)、c(Ag+)均减小 |
| C、由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀 |
| D、向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:2 |
| B、2:2:1 |
| C、2:3:1 |
| D、4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
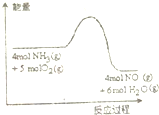 一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )
一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )| A、降低温度可以加快正反应速率 |
| B、反应体系中加入催化剂可增加反应热 |
| C、降低温度可以提高NH3的转化率 |
| D、增加空气的量可以提高混合气体中NO的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄绿色的氯水光照后颜色变浅 |
| B、NO2(g)+SO2(g)?SO3(g)+NO(g),对该平衡体系加压后颜色加深 |
| C、由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 |
| D、在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、反应①的其余产物为H2O和O2 |
| B、反应②中Cl2与FeBr2的物质的量之比为1:2 |
| C、反应③中生成1 mol Cl2,转移电子2 mol |
| D、氧化性由强到弱的顺序为Cl2>MnO4->Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积为11.2L |
| B、摩尔质量是16 g/mol |
| C、质量为32g |
| D、约含有3.01×1023个氧气分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com