
| A、1 molCl2参加反应转移电子数一定为2NA | ||
| B、标准状况下,22.4L空气含有NA个单质分子 | ||
C、在36g
| ||
| D、0.5 mol?L-1AlCl3中含有Cl-数为1.5NA |
| m |
| M |
| m |
| M |
| 36g |
| 36g/mol |


科目:高中化学 来源: 题型:
| A、1:1:2 |
| B、2:2:1 |
| C、2:3:1 |
| D、4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、反应①的其余产物为H2O和O2 |
| B、反应②中Cl2与FeBr2的物质的量之比为1:2 |
| C、反应③中生成1 mol Cl2,转移电子2 mol |
| D、氧化性由强到弱的顺序为Cl2>MnO4->Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积为11.2L |
| B、摩尔质量是16 g/mol |
| C、质量为32g |
| D、约含有3.01×1023个氧气分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
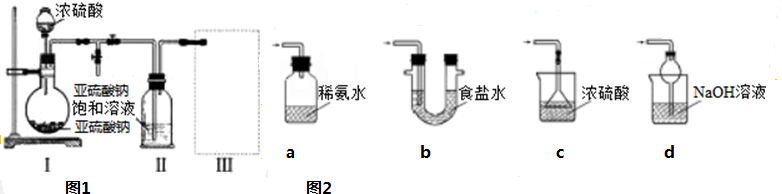

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)可用如图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为如图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.
(1)可用如图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为如图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-═H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
查看答案和解析>>
科目:高中化学 来源: 题型:
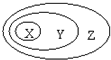 下表中所示物质或概念间的从属关系符合如图的是
下表中所示物质或概念间的从属关系符合如图的是| X | Y | Z | |
| A | 钠元素 | 主族元素 | 短周期元素 |
| B | 电解质 | 化合物 | 纯净物 |
| C | 氢氧化铁 | 胶体 | 分散系 |
| D | 置换反应 | 氧化还原反应 | 放热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com