
����Ŀ����Ԫ�صĵ��ʼ��仯�����ڹ�ũҵ������������������Ҫ���á�
(1)��֪����Ӧi��N2(g)+3H2(g)2NH3(g) ��H����92.4kJ/mol
��Ӧii��2H2(g)+O2(g)=2H2O(g) ��H����483.6kJ/mol
������ȫȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ_____��
(2)��֪��Ӧi�Ͽ�1mol��ѧ��������������±���
N��N | H��H | N��H | |
����/kJ��mol��1 | 945 | 436 | �� |
��Ͽ�1molN��H�������������_______kJ
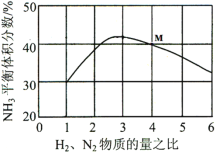
(3)��ͼ��ʾ��Ӧi��500�桢60.0MPa�����£�ԭ����Ͷ�ϱ���ƽ��ʱNH3��������Ĺ�ϵ������ͼ��M�����ݼ���N2��ƽ���������______���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�ı���ʽ______��
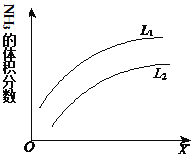
(4)��ͼ�Ǻϳɰ���Ӧƽ��������NH3������������¶Ȼ�ѹǿ�仯�����ߣ�ͼ��L(L1��L2)��X�ֱ�����¶Ȼ�ѹǿ������X��������______(�����¶�������ѹǿ��)���ж�L1��L2�Ĵ�С��ϵ��˵������_______��
(5)�绯ѧ���������������ڼ�����NH3�ĺ������乤��ԭ����ͼ��ʾ��
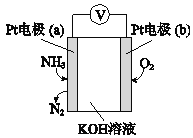
�ٷ�Ӧ����NH3��O2�����ʵ���֮��Ϊ____��
��a���ĵ缫��ӦʽΪ______��
���𰸡�4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H=��1266kJ/mol 390.9 8% 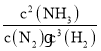 ѹǿ L1��L2�ϳɰ��ķ�Ӧ�Ƿ��ȷ�Ӧ��ѹǿ��ͬʱ���¶����ߣ�ƽ�������ƶ����������������С 4:3 2NH3�C6e��+6OH��=N2+6H2O
ѹǿ L1��L2�ϳɰ��ķ�Ӧ�Ƿ��ȷ�Ӧ��ѹǿ��ͬʱ���¶����ߣ�ƽ�������ƶ����������������С 4:3 2NH3�C6e��+6OH��=N2+6H2O
��������
���ݸ�˹���ɣ���Ӧ�ȼ���ʽ�ش����⣬��ͬ�����£���������ȵ����������ʵ���֮�ȣ�ͨ������ʽ����ƽ���������������ԭ���ԭ���ж�����������������������Ӧ��
(1)���ݸ�˹���ɣ�������ȫȼ�����ɵ�����ˮ�������Ȼ�ѧ����ʽ4NH3(g)+3O2(g)=2N2(g)+6H2O(g)��H=92.4��2kJ/mol��483.6��3kJ/mol=��1266kJ/mol��
(2)������H=��Ӧ�����-��������ܿ�֪���Ͽ�1molN��H�������������![]() kJ��
kJ��
(3)����ͼ��M�����ݣ���ʱ������������Ͷ�ϱ�Ϊ1��4��������ƽ���������Ϊ40%���跴Ӧǰ����������1mol������������4mol��ƽ��ʱ��Ӧ�����˵���xmol�����ݷ�ӦN2+3H22NH3������ʽ��
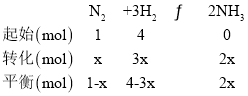
ƽ��ʱ�������������Ϊ![]() ��x=
��x=![]() ����N2��ƽ���������
����N2��ƽ���������![]() ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�ı���ʽΪ
���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�ı���ʽΪ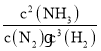 ��
��
(4)�ϳɰ���ӦΪ���ȷ�Ӧ����Ӧ���������������С���ʱ���L���䣬�۲�����һ�����ߣ�����X�������������������˵����Ӧ�����ƶ���������������ԭ����XΪѹǿ��LΪ�¶ȣ�L1��L2���ϳɰ��ķ�Ӧ�Ƿ��ȷ�Ӧ��ѹǿ��ͬʱ���¶����ߣ�ƽ�������ƶ����������������С��
(5)����ͼ������Ӧ���ɵ����������ϼ����ߣ�����������Ӧ��Ϊ��������������b�缫������ԭ��Ӧ��Ϊ������
�ٷ�Ӧ�ܷ���Ϊ4NH3+3O2=2N2+6H2O����Ӧ����NH3��O2�����ʵ���֮��Ϊ4��3��
��a��Ϊ����������������Ӧ���缫��ӦʽΪ2NH3�C6e��+6OH��=N2+6H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪t��ʱ��ijЩ���ʵ�ƽ�ⳣ��K��ֵ�����ʾ������˵���������(����)
���� | HCIO | H2CO3 | AgCl | AgI |
ƽ�ⳣ�� | Ka��10��9 | K��10��7 K��10��11 | Ksp��1.8��10��10 | Ksp��8.51��10��17 |
A.��������ˮ�м�������NaHCO3��ǿ��ˮƯ����
B.��ͬ�¶Ⱥ�Ũ���£�NaClO��Һ��pH��Na2CO3��Һ��pHС
C.t��ʱ��AgCl(s)+I��(aq)![]() AgI(s)+Cl��(aq)��ƽ�ⳣ��K��2.1��106
AgI(s)+Cl��(aq)��ƽ�ⳣ��K��2.1��106
D.��AgCl��AgI�ı�����Һ�������ϣ��ټ�������AgNO3��Һ�������ɵ�����AgCl��AgI����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��������У���������Щ���������ٷ����仯ʱ��������Ӧ��
A��s��+2B��g��![]() C��g��+D��g���Ѵﵽƽ��״̬������ ��
C��g��+D��g���Ѵﵽƽ��״̬������ ��
�� ��������ѹǿ���� ���������ܶȣ��� B�����ʵ���Ũ�ȣ��� ���������ʵ������� ��������ƽ����Է����������� C��D��Ӧ���ʵı�ֵ
A. �ڢۢ� B. �٢ڢ� C. �ڢۢܢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˰�ȫ���������Ⱦ����������㷺��ע���ڱ�ը�ĺ˵�վ��Χ���з��������� ��-131��-137����-131 �������������룬���ܻ�������״���״�ȼ�����
(1)����ͬ�����ǰ������(������������)������Ԫ��X��Y��Z�ĵ�һ���������±���
Ԫ�ش��� | X | Y | Z |
��һ������/(kJ.mol) | 520 | 496 | 419 |
��̬Zԭ�ӵ����ڶ�����ӵ��Ų�ʽΪ______��X��Y��Z����Ԫ���γɵĵ����۵��ɸߵ��͵�˳��Ϊ_______(��Ԫ�ط��ű�ʾ)����ԭ��Ϊ___________ .
(2)F��Iͬ����,BeF2��������ԭ�ӵ��ӻ�����Ϊ_________ ,BeF2������________����(ѡ���������������Ǽ�����)��
(3)��֪�ߵ�����������ʽ,��ѧʽ�ֱ�ΪH5IO6  ��HIO4 ,��������ǿ��˳��Ϊ:H5IO6 ________HIO4(ѡ��">"��"<"��=��)���ӵ����Ƶ��ص���ʽ�ĽǶȷ���,H5IO6�����еĻ�ѧ����________(д������).
��HIO4 ,��������ǿ��˳��Ϊ:H5IO6 ________HIO4(ѡ��">"��"<"��=��)���ӵ����Ƶ��ص���ʽ�ĽǶȷ���,H5IO6�����еĻ�ѧ����________(д������).
(4)131I2����ľ����ṹ��ͼ����ʾ���þ�����ƽ������________��131Iԭ�ӣ������е���ӵ�������_________�ֲ�ͬ�ķ���

(5)KI�ľ����ṹ��ͼ����ʾ��ÿ��K����Χ���ڵ�K������Ϊ_______����KI������ܶ�Ϊ��g.cm-3 ,K��I��ԭ�Ӱ뾶�ֱ�Ϊrkcm��rI cm,�����ӵ�������ֵΪNA,�� KI�����еĿռ�������Ϊ_______. �ۿռ�������=(�����/�������)��100%,�������ĸ�Ĵ���ʽ��ʾ���ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��Fe��������Ҫ��Ԫ�أ��䵥�ʼ�����������������ж��й㷺��Ӧ�á�
��1����̬N ԭ������ܼ��ĵ���������ͼ��״Ϊ_____________��Nԭ�ӵĵ�һ�����ܱ�Oԭ�ӵĴ���ԭ����_________________________����̬��ԭ�ӵļ۵����Ų�ͼΪ_______
��2���ڸ�ѹ�µ����ᷢ���ۺϵõ��߾۵�������ṹ��ͼ��ʾ��������ÿ����ԭ��������������ԭ�ӽ���γɿռ���״�ṹ����ԭ�ӵ��ӻ��������Ϊ_________�����ָ߾۵�N-N ���ļ���Ϊ160kJ/mol����N2 �ļ���Ϊ942kJ/mol�������DZ�ڵ�Ӧ����______________________��

��3���������ƺ��������(HN3)��һ�����������ǵ������������ȫ���ҵȡ�
��д����N3-���ڵȵ������һ�ַ���__________�������ʽ����
���������(HN3)������(N2H4)��HNO2�����Ƶã�ͬʱ����ˮ�����������������___�����ţ�
A����������HN3�Ļ�ѧ����ʽΪ��N2H4+HNO2= HN3+2 H2O
B��NaN3�ľ����ܴ���KN3�ľ�����
C���������(HN3)��ˮ���γɷ��Ӽ����
D��HN3��N2H4�����ɼ��Լ��ͷǼ��Լ����ɵķǼ��Է��ӡ�
E��HN3�������ĸ�ԭ�ӿ�����һ��ֱ����
��4��ij�����������������ᄃ����ͼ��ʾ������A��B������ɡ���û�������Fe2+��Fe3+��O2-�ĸ�����Ϊ______(�����������)����֪�þ�����ܶ�dg/cm3,�����ӵ�������ֵΪNA��������Ϊ______nm(�ú�d��NA�Ĵ���ʽ��ʾ)��

��5��һ������̼�γɵļ�϶������ľ���ṹ��ͼ��ʾ������̼ԭ��λ����ԭ���γɵİ���������ġ�ÿ����ԭ����Ϊ���������干�á���û�����Ļ�ѧʽΪ_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������[(NH4)2SO4]һ�������ĵ���(�׳Ʒ����)��������һ�������������ʹ֦Ҷ������ʢ����߹�ʵƷ�ʺͲ�������ǿ������ֺ��ĵֿ��������������ʡ��ʺ��ַʣ������������ڼ��ȵ������¿������ɰ�����������ѧ֪ʶ�ش��������⣺
��1����̬Sԭ�ӵļ۵����Ų�ʽΪ____________��������ߵĵ����������ܲ�ķ���Ϊ_________��
��2��SO42-�ռ乹��Ϊ__________������ԭ�ӵĹ���ӻ���ʽ��________��д��һ����SO42-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ__________��
��3�������ķе�(-33.5��)��������ķе�(-60.4��)����Ҫԭ���ǣ�_____________________________��
��4��O��N��S�ĵ�һ�����ܴӴ�С��˳����___________________��
��5������ͭ��Һ��ͨ������İ���������[Cu(NH3)4]SO4,1mol��[Cu(NH3)4]2+�������ĸ���Ϊ________��
��6�������Ȼ��ѡ�̼���ơ�����������ԭ�ϣ���������̼�����ѻ������ṹ����ͼ��ʾ������̼�����ѻ�����Ļ�ѧʽΪ________�������þ���ľ��������иʹ̼ԭ��λ���¾������������ģ���ԭ�����¾����е�λ����__________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����еķ�Ӧ������ͬһ��Ӧ���͵���
A. �������ˮ���Ʊ������ɱ�ϩ��ˮ��Ӧ�Ʊ���
B. �ɼױ������ƶ������ױ����ɼױ������Ʊ�����
C. ���ȴ���������ȥ�ƻ���ϩ���ɱ�ϩ������![]() �������
�������
D. ��������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽѧ�ϳ������Ը��������Һ�Ͳ�����Һ�ķ�Ӧ���ڲⶨѪ�Ƶĺ������ش��������⣺__H++__MnO4��+__H2C2O4��__CO2��+__Mn2++__________
��1����ƽ�������ӷ���ʽ������![]() ������������������֡�
������������������֡�
��2���÷�Ӧ�еĻ�ԭ����___��
��3����Ӧת����0.4mol���ӣ�������KMnO4�����ʵ���Ϊ___mol��
��4���ⶨѪ�Ƶĺ����ķ����ǣ�ȡ2mLѪҺ������ˮϡ�ͺ������м���������NH4��2C2O4��Һ����Ӧ����CaC2O4��������������ϡ�����ܽ�õ�H2C2O4������KMnO4��Һ�ζ���
��ϡ�����ܽ�CaC2O4�����Ļ�ѧ����ʽ��__��
���ܽ����ʱ__���ܻ��ܣ���ϡ���ᣬԭ����___��
����������1.0��10-4mol/L��KMnO4��Һ20.00mL����100mL��ѪҺ�к���__g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯��![]() ����������Ԫ����
����������Ԫ����![]() �ۣ�NaH��ˮ��Ӧ�ų�
�ۣ�NaH��ˮ��Ӧ�ų�![]() ������������ȷ����( )
������������ȷ����( )
A.��NaH�е������Ӱ뾶������Ӱ뾶��
B.��NaH�е������ӵĵ��Ӳ��Ų���![]() ����ͬ
����ͬ
C.NaH��ˮ��Ӧ����Һ������
D.NaH�е������ӱ���ԭ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com